Перейти к:
Локализация NO-синтазы и малых апоптотических молекул в слизистой оболочке полости носа при полипозном риносинусите
https://doi.org/10.34215/1609-1175-2022-3-63-69
Аннотация
Цель: изучение локализации NO-синтазы и маркеров апоптоза в слизистой оболочке полости носа у пациентов с полипозным риносинуситом (ПРС).
Материалы и методы. Исследовали биопсийный материал полипов полости носа и участков слизистой оболочки нижних носовых раковин пациентов женского и мужского пола в возрасте 35–70 лет (n = 70, средний возраст 57,4 ± 1,52), находящихся на хирургическом лечении в оториноларингологическом отделении Владивостокской клинической больницы № 1. Основную группу составлял материал полипов, полученный от пациентов (n = 50) во время хирургических операций (полипотомия) с клинически верифицированным диагнозом «полипозный риносинусит» без сопутствующей патологии слизистой оболочки носа. Контроль: два варианта образцов слизистой оболочки полости носа. Первая группа (контроль I) – материал слизистой оболочки полости носа пациентов с диагнозом «искривление перегородки носа», которым была проведена риносептопластика (n = 20) без полипозной и сопутствующей воспалительной и аллергической патологии. Вторая группа (контроль II) – материал слизистой оболочки нижних носовых раковин (n = 50), полученный при хирургическом лечении основной группы пациентов.
Результаты. В настоящей работе показано возрастание экспрессии маркеров nNOS/iNOS в клетках слизистой оболочки полости носа при ПРС, которое коррелирует с распределением проапоптотических факторов р53 и каспаза-3 и зависит от клинико-морфологического типа полипов.
Заключение. Развитие ПРС сопровождается усилением экспрессии NOS и факторов апоптоза в слизистой оболочке полости носа. Особенности специфического сигнального микроокружения обеспечивают особые условия для формирования полипов различного морфологического типа.
Для цитирования:
Павлуш Д.Г., Матвеева Н.Ю. Локализация NO-синтазы и малых апоптотических молекул в слизистой оболочке полости носа при полипозном риносинусите. Тихоокеанский медицинский журнал. 2022;(3):63-69. https://doi.org/10.34215/1609-1175-2022-3-63-69
For citation:
Pavlush D.G., Matveeva N.Yu. Localization of nitric oxide syntases and small apoptotic molecules in the nasal mucosa in polypoid rhinosinusitis. Pacific Medical Journal. 2022;(3):63-69. (In Russ.) https://doi.org/10.34215/1609-1175-2022-3-63-69
Полипозный риносинусит (ПРС) характеризуется хроническим воспалением, активной пролиферацией эпителия и соединительнотканных клеток слизистой оболочки полости носа [1]. Большое значение в активации полипозного роста представляют воспалительные и аллергические факторы, нейропептиды и газообразные мессенджеры [1][2]. Их гетерогенное и комплексное воздействие на слизистую оболочку ведет к формированию трех клинико-морфологических типов полипов: отечному с гиперплазией слизистых желез, аллергическому (эозинофильному) и фиброзному с выраженным кистообразованием и васкуляризацией серозно-слизистых желез в подслизистой основе [1][3]. ПРС является мультифакторным заболеванием, часто встречается в сочетании с непереносимостью нестероидных противовоспалительных препаратов, бронхиальной астмой, муковисцидозом и синдромом Картагенера [1][2][4].
Известно, что ведущая регулирующая роль в патогенезе ПРС принадлежит избыточной продукции оксида азота (NO), который участвует в регуляции мукоцилиарной активности, сосудистого тонуса, оказывает выраженное провоспалительное действие [5]. Продукты метаболизма NO также модулируют клеточный цикл, нарушение которого неизменно связывают с формированием полипов [5][6]. Однако изменения молекулярного сигналинга и динамики обновления клеток при полипозной трансформации остаются невыясненными.
Цель настоящей работы состояла в изучении локализации NO-синтазы и маркеров апоптоза в слизистой оболочке полости носа у пациентов с ПРС.
Материал и методы
Исследовали биопсийный материал полипов полости носа и участков слизистой оболочки нижних носовых раковин пациентов женского и мужского пола в возрасте 35–70 лет (n = 70, средний возраст 57,4 ± 1,52 года), находящихся на хирургическом лечении в оториноларингологическом отделении КГБУЗ «Владивостокская клиническая больница № 1». Исследование одобрено междисциплинарным комитетом по этике ФГБОУ ВО ТГМУ Минздрава РФ (протокол № 5 от 17 января 2022 г.) и соответствует Хельсинкской декларации Всемирной ассоциации «Этические принципы проведения научных медицинский исследований с участием человека». Все пациенты дали информированное согласие на участие в исследовании.
Основную группу составлял материал полипов, полученный от пациентов (n = 50) во время хирургической операции (полипотомия) с клиническим верифицированным диагнозом «полипозный риносинусит» без сопутствующей воспалительной (гнойный верхнечелюстной риносинусит) и аллергической (аллергический ринит, бронхиальная астма, аспириновая триада) патологии слизистой оболочки носа.
В качестве контроля исследовались два варианта образцов слизистой оболочки полости носа. Первая группа (контроль I) – материал слизистой оболочки полости носа, полученный у пациентов с диагнозом «искривление перегородки носа», которым была проведена риносептопластика (n = 20) без полипозной и сопутствующей воспалительной и аллергической патологии. Вторая группа (контроль II) – материал слизистой оболочки нижних носовых раковин (n = 50), полученный у пациентов с клиническим диагнозом «полипозный риносинусит», составляющих основную группу.
Критерии исключения из исследования: тяжелое иммунодефицитное состояние (ВИЧ-инфекция, заболевания крови и пр.), антрохоанальные полипы, инвертированная папиллома, злокачественные заболевания полости носа и околоносовых пазух.
Материал фиксировали в 4% растворе параформальдегида на фосфатном буфере в течение 24 часов, после чего промывали 0,1-М Na-фосфатном буфере (рН 7,2) с 6–7-кратной сменой раствора и заливали в парафин по общепринятой методике. Срезы толщиной 5 мкм монтировали на предметные стекла с адгезивным покрытием, депарафинировали и инкубировали с первичными мышиными моноклональными антителами против iNOS (Abсam, ab3523, Великобритания) в разведении 1:100, nNOS (Abсam, ab40662, США) в разведении 1:150, p53 (Abсam ab28, Великобритания) в разведении 1:250 и кроличьими моноклональными антителами против caspase-3 (Thermo Fisher Scientific 700182, США) в разведении 1:50. Антитела разводили на фосфатном буфере, содержащем Тритон Х-100 и бычий сывороточный альбумин, инкубировали в течение ночи при температуре 4 °С. После промывки срезы в течение 1 ч инкубировали в растворе биотинилированных вторичных антител против иммуноглобулина кролика и мыши соответственно первичным антителам, в разведении в соответствии с инструкциями фирмы производителя (Vector Laboratories, США). После отмывки вторичных антител препараты инкубировали в растворе авидин-пероксидазного комплекса (Vectastain ABC Kit, Vector Laboratories, США). Срезы выдерживали в 0,03% растворе диаминобензидина и 0,01% перекиси водорода на фосфатном буфере в течение 10–20 мин, затем промывали, обезвоживали и заключали в бальзам по обычным правилам. В качестве контроля из среды исключали первичные антитела, окрашивание клеток отсутствовало. Часть срезов докрашивали гематоксилином Майера.
Препараты изучали в световом микроскопе AxioScope A1 (Carl Zeiss, Германия) и фотографировали при помощи цифровой камеры AxioCam ICc3. Морфометрическую обработку полученных фотографий проводили при помощи пакета программ AxioVision 4.8.1. На микрофотографиях оценивали плотность распределения иммунопозитивных клеток слизистой оболочки носа в контрольных группах и ткани полипа. Данные измерения проводились на срезах, докрашенных гематоксилином Майера в 10 неперекрывающихся полях зрения на каждом препарате. Определение площади иммуногистохимического окрашивания проводили с использованием программы ImageJ 4.0 и Scion ImageJ после получения изображения камерой AxioCamICc3 Rev.3 (Carl Zeiss). Статистическую обработку данных проводили с помощью программ Microsoft Excel 2010 и Statistica 10. Значение исследуемых объектов отличалось от нормального распределения (критерии Шапиро – Уилка). В сравниваемых группах количественные данные представляли в виде медианы и межквартильных интервалов Med (Нкв, Вкв), где Med – медиана, Нкв – нижний квартиль, Вкв – верхний квартиль. Данные обрабатывали методом вариационной статистики с определением t-критерия достоверности по Стьюденту (p < 0,05).
Результаты исследования
В слизистой оболочке полости носа контрольной группы I выявляется экспрессия nNOS, которая распределяется преимущественно в субэпителиальной и железистой зоне собственной пластинки слизистой оболочки. Фермент локализуется в нервных волокнах, оплетающих концевые отделы и выводные протоки желез (рис. 1 а). Эпителиоциты слизистой оболочки nNOS не содержат.
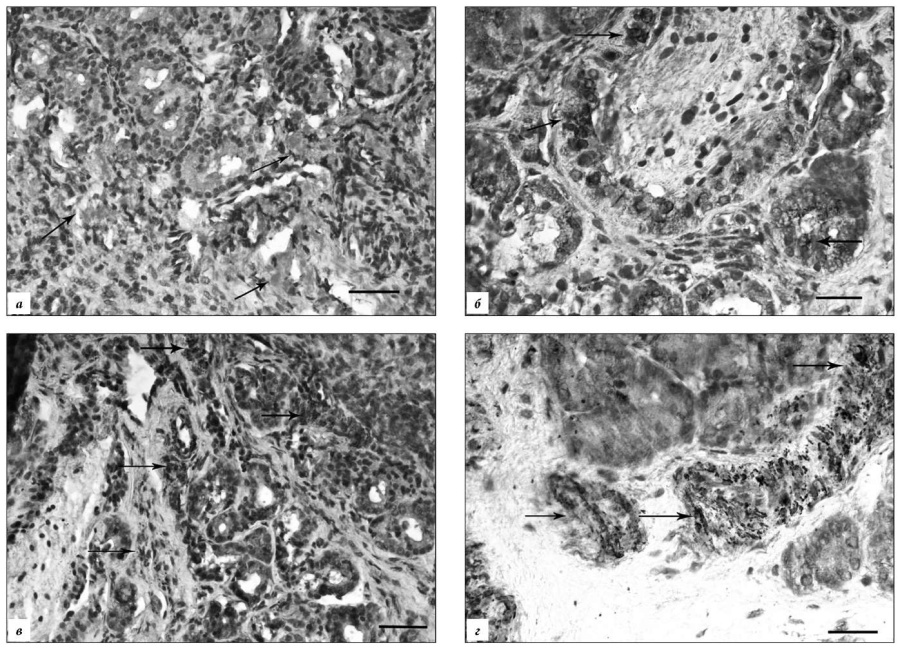
Рис. 1. Иммунолокализация nNOS в слизистой оболочке полости носа в контроле и при полипозном риносинусите.
а – NO-ергические волокна, оплетающие концевые отделы и выводные протоки желез (стрелки) (контроль I); б – локализация nNOS в клетках концевых отделов и выводных протоков желез (стрелки) слизистой оболочки при ПРС отечного типа (контроль II); в – распределение nNOS в клетках концевых отделов и выводных протоков желез (стрелки) глубокого слоя собственной пластинки слизистой оболочки при ПРС фиброзного типа (контроль II); г – многочисленные nNOS-иммунореактивные клетки выводных протоков желез (стрелки) в ткани полипа фиброзного типа.
Докрашено гематоксилином Майера. Масштаб: а, в – 50 мкм, б, г – 100 мкм.
Характер локализации nNOS в слизистой оболочке контроля II меняется при ПРС и зависит от морфологического типа полипов. Количество nNOS-реактивных клеток здесь закономерно увеличивается во всех слоях слизистой оболочки, а плотность nNOS-позитивных нервных волокон неизменно снижается (табл.). В ткани полипов отечного типа nNOS локализуется главным образом в клетках концевых отделов желез и их выводных протоков (рис. 1 б). При полипах эозинофильного (аллергического) типа nNOS избирательно выявляется в эпителии, а в собственной пластинке маркирует эндотелиоциты микрососудов, выводные протоки и концевые отделы желез. При полипах фиброзного типа возрастание экспрессии nNOS определяется в отдельных железистых элементах, субэпителиальных участках соединительной ткани и микрососудах (рис. 1 в), иногда встречается на уровне базальной мембраны (табл.).
Таблица
Плотность распределения иммунопозитивных клеток собственной пластинки слизистой оболочки в различных морфологических типах ПРС (Med, Нкв, Вкв, в 0,1 мм2)
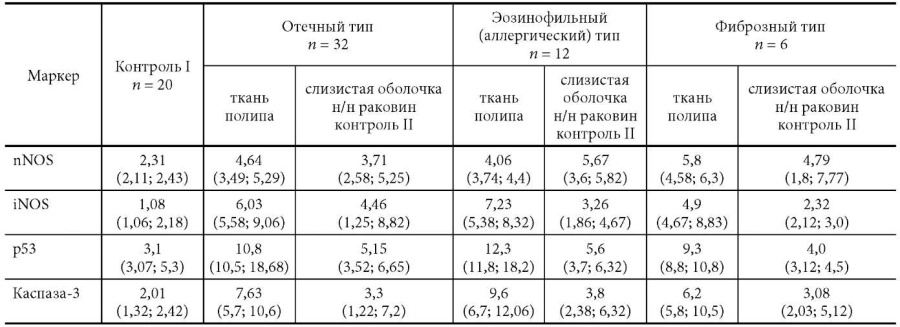
Результаты представлены в виде Med (Нкв, Вкв), где Med – медиана, Нкв – нижний квартиль, Вкв – верхний квартиль.
Статистически значимые отличия от группы контроля (p ≤ 0,05)
Для ткани полипов характерно преимущественное субэпителиальное распределение nNOSиммунореактивных структур, где выявляются нервные волокна и фибробластоподобные клетки. При отечном и эозинофильном (аллергическом) типах полипов nNOS-позитивные клетки и волокна обнаруживаются по ходу кровеносных сосудов. В полипах фиброзного типа nNOS маркирует эпителиоциты желез, небольшую популяцию мононуклеарных клеток и единичные нервные волокна (рис. 1 г).
В слизистой оболочке полости носа у пациентов из группы контроля I экспрессия iNOS резко снижена.
Здесь iNOS преимущественно локализуется в апикальной части эпителиоцитов выводных протоков желез (рис. 2 а). Активность iNOS в слизистой оболочке контроля II значительно нарастает в первую очередь за счет экспрессии фермента в стенке кровеносных сосудов и железистых эпителиоцитах.
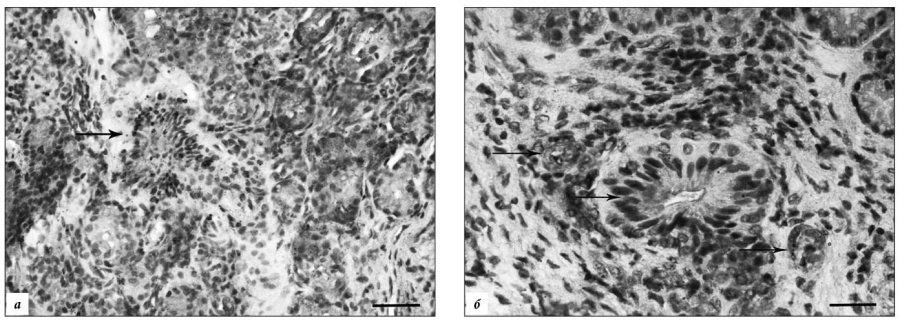
Рис. 2. Локализация iNOS в слизистой оболочке полости носа и ткани полипа.
а – редкие iNOS-иммунореактивные эпителиоциты концевых отделов желез собственной пластинки слизистой оболочки (стрелка) при ПРС отечного типа (контроль II); б – в ткани полипа отечного типа количество iNOS-позитивных эпителиоцитов концевых отделов и выводных протоков желез (стрелки) увеличивается. Докрашено гематоксилином Майера. Масштаб: а – 50 мкм, б – 30 мкм.
В образцах ткани полипов отечного типа iNOS локализуется в реснитчатых и бокаловидных эпителиоцитах и в клетках субэпителиального слоя. В железистой зоне собственной пластинки данный маркер присутствует в эндотелиоцитах микрососудов и умеренно маркирует соединительнотканные клетки (рис. 2 б). В полипе эозинофильного (аллергического) типа iNOS маркирует лишь небольшую группу эпителиоцитов железистой зоны, но активно маркирует обширную популяцию клеток воспалительных инфильтратов. В полипах фиброзного типа фермент выявляется в клетках субэпителиальной зоны, стенке крупных кровеносных сосудов и железистых эпителиоцитах.
Во всех слоях слизистой оболочки полости носа группы контроля I мы обнаружили небольшое количество р53и каспаза-3-реактивных клеток. В группе контроля II р53 и каспаза-3 выявлялись преимущественно в клетках воспалительных инфильтратов (табл.).
Маркеры апоптоза при ПРС выявляются во всех слоях слизистой оболочки и в очагах воспалительных инфильтратов. В полипах всех исследованных типов отмечается высокая экспрессия р53 и умеренная позитивная реакция на каспазу-3 (рис. 3 а, в). Иммунореактивные клетки, как правило, располагаются под базальной мембраной, вокруг сосудов или диффузно в рыхлой соединительной ткани. В собственной пластинке слизистой оболочки определяется заметное увеличение р53-иммунопозитивных клеток (табл.).
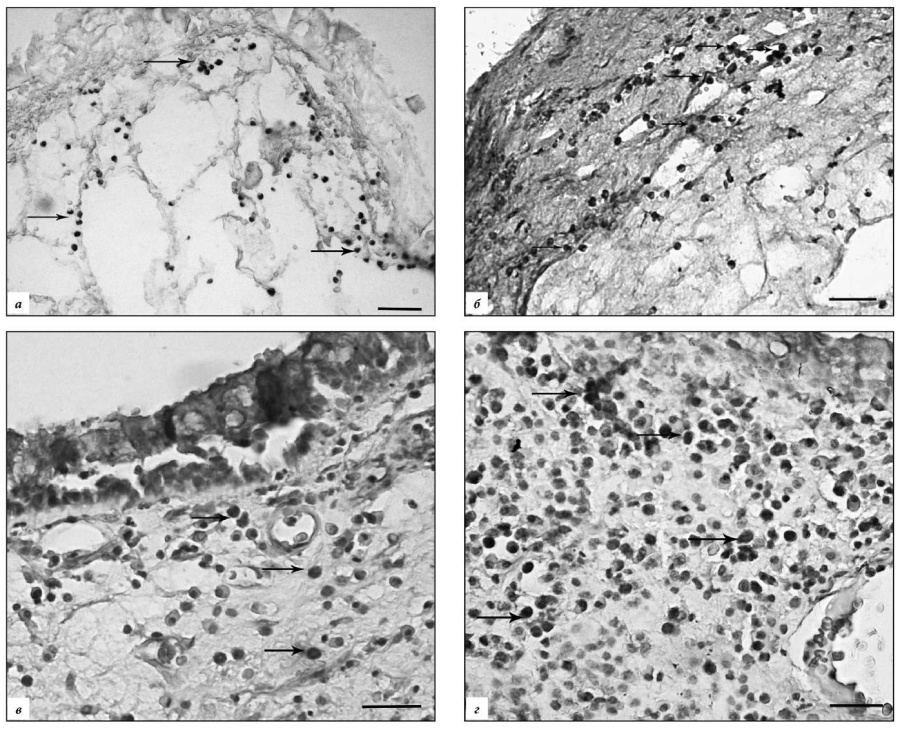
Рис.3. Распределение маркеров апоптоза в слизистой оболочке полости носа в контроле и при полипозном риносинусите.
а – локализация р53 в клетках воспалительного инфильтрата (стрелки) в собственной пластинке слизистой оболочки при ПРС отечного типа (контроль II); б – р53-иммунопозитивные клетки воспалительного инфильтрата (стрелки) в ткани полипа эозинофильного (аллергического) типа; в – каспаза-3-реактивные эпителиоциты и клетки воспалительного инфильтрата (стрелки) в ткани полипа отечного типа; г – иммунолокализация каспазы-3 в клетках воспалительного инфильтрата субэпителиальной зоны (стрелки) в ткани полипа эозинофильного (аллергического) типа. Докрашено гематоксилином Майера в, г. Масштаб: а, б – 100 мкм, в, г – 50 мкм.
В ткани полипов фиброзного типа выявляются участки с редкими скоплениями каспаза-3-реактивных фибробластов. Кроме того, в глубоких слоях собственной пластинки и под эпителием располагаются очаговые или диффузные полиморфноклеточные инфильтраты с умеренной иммунореактивностью на каспазу-3 (рис. 3 г). Распределение р53 преобладает в клетках субэпителиального слоя (рис. 3 б). (табл.)
Обсуждение полученных данных
В настоящей работе показано возрастание экспрессии nNOS/iNOS в клетках слизистой оболочки полости носа при ПРС, которое коррелирует с распределением проапоптотических факторов и зависит от клиникоморфологического типа полипов.
Значение апоптоза в развитии хронических воспалительных заболеваний подтверждено в ряде исследований [7–9]. Хорошо известны морфологические критерии апоптоза и сложные каскады молекулярных реакций, запускающих и стабилизирующих программированную гибель клеток [10–12]. Апоптоз инициируют более 30 факторов, однако его эффекторную стадию запускают каспаза-3 и факторы транскрипции р53 и р21. Баланс этих молекул контролируют пептиды, блокирующие наступление апоптоза, где Bcl-2 и MDM2 принадлежит основная регулирующая роль [13][14].
Развитие ПРС происходит на фоне повышенной выработки ключевых воспалительных факторов (IL-5, CCL11, TNF, TGF-β) и нейропептидов (субстанция P, вазоинтестинальный полипептид, нейропептид Y). Эти факторы способны индуцировать также патологические формы апоптоза клеток слизистой оболочки полости носа [14][15]. Однако по другим данным [9], в ткани полипов обнаруживается сверхэкспрессия противоапоптотического белка Bcl-2, который противостоит распространению апоптоза. По нашим данным, ПРС сопровождается увеличением количества р53-иммунореактивных клеток и умеренной экспрессией каспазы-3 в эпителии и собственной пластинке слизистой оболочки.
Наибольшее количество р53-иммунореактивных клеток выявляется в полипах аллергического типа. В этом случае превалируют иммунокомпетентные клетки, эозинофилы и тучные клетки. Можно полагать, что хроническое иммунное воспаление при ПРС ведет к формированию гетерогенных популяций клеток, одна из которых элиминируется через апоптоз, а другая поддерживает непрерывный полипогенез. Необходимо отметить, что в полипах фиброзного типа пролиферация и гибель клеток незначительна, что также находит подтверждение при исследовании каспазы-3 у пациентов с ПРС [3][10][15].
Баланс про-и антиапоптотических факторов формирует молекулярный «реостат», определяющий динамику и исход хронического иммунного воспаления [7][10][11]. Морфологическим эквивалентом этого баланса является установленное нами соотношение р53/каспаза-3 в тканях полипов. Распространение программированной гибели клеток при ПРС представляет результат регуляции специфических генов, где эпигенетические воздействия остаются определяющими [3]. Потенциальный канал такого взаимодействия может представлять синтез NO.
Нами установлено значительное нарастание активности конститутивной и индуцибельной изоформы NOS в соединительной ткани и эпителии полипов. Повышенная выработка NO в этой ситуации повышает проницаемость сосудистой стенки, усиливает отек подслизистой основы, стимулирует миграцию воспалительных клеток и секрецию слизи в железах и бокаловидных клетках. При развитии ПРС наблюдается общая тенденция к увеличению содержания nNOS-позитивных клеточных элементов на фоне снижения активности маркера в нервных волокнах. Активность маркера обнаруживается в эндотелиоцитах кровеносных сосудов, клетках подслизистой основы и особенно выражена в субэпителиальной зоне. Ключевая роль NO при ПРС в качестве координатора местных нейроиммунных механизмов ремоделирования слизистой оболочки полости носа, что, в свою очередь, и способствует усилению рецидивирования ПРС.
Заключение
Развитие ПРС сопровождается усилением экспрессии NOS и факторов апоптоза в слизистой оболочке полости носа. Особенности специфического сигнального микроокружения обеспечивают особые условия для формирования полипов различного морфологического типа. Исследования разных путей регуляции апоптоза способствует всестороннему пониманию молекулярно-клеточных механизмов повреждения слизистой оболочки полости носа при ПРС и необходимы для разработки новых подходов эффективной терапии данной группы заболеваний.
Конфликт интересов: авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Источник финансирования: авторы заявляют о финансировании проведенного исследования из собственных средств.
Список литературы
1. Павлуш Д.Г., Павлуш Е.Н., Матвеева Н.Ю., Калиниченко С.Г., Дюйзен И.В. Хронический полипозный риносинусит: этиопатогенетические механизмы его возникновения. Медицина. 2018;6(2):69–78. doi: 10.29234/2308-9113-2018-6-2-69-78
2. Козлов В.С., Савлевич Е.Л. Полипозный риносинусит. Современные подходы к изучению патогенеза, диагностике и лечению. Вестник оториноларингологии. 2015;80(4):95-9. doi: 10.17116/otorino201580495-99
3. Матвеева Н.Ю., Павлуш Д.Г., Калиниченко С.Г. Экспрессия про- и антиапоптотических молекул в слизистой оболочке полости носа при полипозном риносинусите. Вестник оториноларингологии. 2020;85(3):43–7. doi: 10.17116/otorino20208503143
4. Van Drunen CM, Mjosberg JM, Segboer CL, Cornet ME, Fokkens WJ. Role of innate immunity in the pathogenesis of chronic rhinosinusitis: progress and new avenues. Curr Allergy Asthma Rep. 2012;5(12):120–6.
5. Tian P, Sun Y, Li Y, Liu X, Wan L, Li J, et al. A Global Analysis of Tandem 3'UTRs in Eosinophilic Chronic Rhinosinusitis with Nasal Polyps. PLoS ONE 2012; 7(11):1–12. doi: 10.1371/journal.pone.0048997
6. Cho SW, Kim DY. Lessons. From Localized Chronic Rhinosinusitis With Nasal Polyps. Allergy Asthma Immunol Res. 2021;13(6):827–9. doi: 10.4168/aair.2021.13.6.827
7. Uller L, Andersson M, Greiff L, Persson CG., Erjefält J.S. Occurrence of apoptosis, secondary necrosis, and cytolysis in eosinophilic nasal polyps. Am. J. Respir. Crit. Care. Med. 2004;170(7):742–7. doi: 10.1164/rccm.200402-240oc
8. Galvão dos Anjos CP, Vasconcelos AC, Tormin Borges Crosara PF, Coelho dos Anjos G, Becker CG, Santos Guimarães RE. Apoptosis in eosinophilic nasal polyps treated in vitro with Mitomycin C. Braz. J. Otorhinolaryngol. 2012;78(3):32–7. doi: 10.1590/S1808-86942012000300007
9. Davidsson A, Anderson T, Hellquist HB. Apoptosis and phagocytosis of tissue-dwelling eosinophils in sinonasal polyps. Laryngoscope. 2000;110:111–6. doi: 10.1097/00005537-200001000-00020
10. Матвеева Н.Ю. Апоптоз: морфологические особенности и молекулярные механизмы. Тихоокеанский медицинский журнал. 2003;4:12–6.
11. Dubikov AI, Kalinichenko SG. Small molecules regulating apoptosis in the synovium in rheumatoid arthritis. Scand J. Rheumatol. 2010;39(5):368–72. doi: 10.3109/03009741003742771.
12. Henson PM, Bratton DL. Antiinflammatory effects of apoptotic cells. J. Clin. Invest. 2013;123(7):2773–4. doi: 10.1172/JCI69344
13. Küpper DS, Valera FC, Malinsky R, Milanezi CM, Silva JS, Tamashiro E, Anselmo-Lima WT. Expression of apoptosis mediators p53 and caspase 3, 7, and 9 in chronic rhinosinusitis with nasal polyposis. Am J Rhinol Allergy. 2014;28(3):187–91. doi: 10.2500/ajra.2014.28.4022
14. Cakabay T, Sayin I, Erdu O, Muhammedoglu A, Tekke NS, Kayhan FT. Role of Apoptosis in the Pathogenesis of Nasal Polyps Based Upon Galectin-3 Expression. Journal of Craniofacial Surgery 2017;28(1):280–4. doi: 10.1097/SCS.0000000000003174
15. Frendo M, Håkansson K, Schwer S, Ravn AT, Meteran H, Porsbjerg C, Backer V, von Buchwald C. Exhaled and nasal nitric oxide in chronic rhinosinusitis patients with nasal polyps in primary care. Rhinology. 2018;56(1):59–64. doi: 10.4193/Rhin17.111
Об авторах
Д. Г. ПавлушРоссия
старший преподаватель кафедры гистологии, эмбриологии и цитологии,
690002, г. Владивосток, пр-т Острякова, 2
Н. Ю. Матвеева
Россия
690002, г. Владивосток, пр-т Острякова, 2
Рецензия
Для цитирования:
Павлуш Д.Г., Матвеева Н.Ю. Локализация NO-синтазы и малых апоптотических молекул в слизистой оболочке полости носа при полипозном риносинусите. Тихоокеанский медицинский журнал. 2022;(3):63-69. https://doi.org/10.34215/1609-1175-2022-3-63-69
For citation:
Pavlush D.G., Matveeva N.Yu. Localization of nitric oxide syntases and small apoptotic molecules in the nasal mucosa in polypoid rhinosinusitis. Pacific Medical Journal. 2022;(3):63-69. (In Russ.) https://doi.org/10.34215/1609-1175-2022-3-63-69





































