Перейти к:
Антибактериальное и антибиопленочное действия бактериофагов в отношении Klebsiella pneumoniae и Pseudomonas aeruginosa, выделенных от пациентов с ортопедической инфекцией
https://doi.org/10.34215/1609-1175-2023-1-59-63
Аннотация
Цель: оценить чувствительность К. pneumoniae и P. aeruginosa к препарату поливалентного бактериофага и его влияние на биопленкообразование и сформированную биопленку штаммов, выделенных от пациентов с ортопедической инфекцией.
Материалы и методы. Протестировано 50 клинических изолятов K. pneumoniae и 50 – P. aeruginosa. Идентификацию выполняли методом MALDI-TOF-MS, антибиотикочувствительность оценивали в соответствии с EUCAST v.21. Детекцию генов карбапенемаз осуществляли методом ПЦР в реальном времени. Чувствительность клинических штаммов к поливалентному пиобактериофагу определяли методом спот-теста, а K. pneumoniae ATCC 33495 и P. aeruginosa – ATCC 27853 при оценке кинетических кривых роста. Биопленки чувствительных к бактериофагам штаммов формировали по методу O’Toole путем совместной инкубации бактерий с фагами. Влияние бактериофагов на 24-часовые биопленки оценивали сравнением оптической плотности экстрактов красителя обработанных бактериофагом лунок и контрольных при 570 нм.
Результаты. 7 (14%) клинических штаммов K. pneumoniae и 15 (30%) P. aeruginosa были устойчивы к карбапенемам. 6 изолятов K. pneumoniae продуцировали NDM-кабапенемазы, 4 изолята P. aeruginosa – VIM-карбапенемазы. Коммерческий препарат бактериофага был активен в отношении 36% и 56% штаммов K. pneumoniae и P. aeruginosa соответственно, включая 1 из 6 и 4 из 15 карбапенем-устойчивых изолятов. Большинство изученных штаммов снижали продукцию биопленок при совместной инкубации с фагом, однако снижение биомассы более 80% выявлено только для P. aeruginosa. Воздействие бактериофага на уже сформированные биопленки было менее выраженным, несмотря на снижение биомассы биопленок у 78% и 68% штаммов K. pneumoniae и P. aeruginosa соответственно.
Заключение. Полученные результаты свидетельствуют о перспективности дальнейших исследований, посвященных изучению активности бактериофагов в отношении возбудителей ортопедической имплантат-ассоциированной инфекции, и разработки методов фаготерапии для лечения профильных пациентов.
Ключевые слова
Для цитирования:
Гордина Е.М., Божкова С.А., Смирнова Л.Н. Антибактериальное и антибиопленочное действия бактериофагов в отношении Klebsiella pneumoniae и Pseudomonas aeruginosa, выделенных от пациентов с ортопедической инфекцией. Тихоокеанский медицинский журнал. 2023;(1):59-63. https://doi.org/10.34215/1609-1175-2023-1-59-63
For citation:
Gordina E.M., Bozhkova S.A., Smirnova L.N. Anti-bacterial and anti-biofilm activity of bacteriophages against Klebsiella pneumoniae and Pseudomonas aeruginosa isolated from orthopedic patients. Pacific Medical Journal. 2023;(1):59-63. (In Russ.) https://doi.org/10.34215/1609-1175-2023-1-59-63
Антибиотикорезистентность является значительной и широко обсуждаемой проблемой системы здравоохранения [1][2]. В 2019 г. было зарегистрировано 4,95 млн случаев смерти, связанных с бактериальной устойчивостью, в том числе 1,27 млн летальных исходов, напрямую вызванных антибиотикорезистентными штаммами [3].
Во второй половине ХХ века фаготерапию ограниченно применяли только в СССР и Польше, а вопрос о регистрации препаратов с вариабельным составом бактериофагов перед регуляторами фармацевтического рынка не возникал [4]. Отсутствие общепринятых подходов является существенной преградой для выхода фагов на мировой фармацевтический рынок. Бактериофаги по-прежнему не имеют одобрения на фармакологическом рынке западной медицины в качестве зарегистрированного лекарственного средства, но все чаще используются в качестве персонализированной терапии для лечения инфекций, вызванных устойчивыми к антибиотикам бактериями [1][2].
Инфекции костей и суставов после травм и ортопедических операций являются особой формой глубокой локализованной инфекции, которая с учетом высокой частоты хронизации и слабого ответа на антибиотики, представляет потенциальную мишень для бактериофагов. В 10–20% случаев причиной таких инфекционных осложнений являются грамотрицательные патогены [5]. Наличие у бактерий различных механизмов резистентности к антибиотикам, а также формирование микробных биопленок на поверхности имплантированных ортопедических конструкций и на окружающих тканях могут приводить к неэффективности проводимой антибактериальной терапии.
Хотя ведущими возбудителями инфекции, ассоциированных с ортопедическими имплантатами, являются стафилококки, участие в этиологии грамотрицательных возбудителей, включая Klebsiella pneumoniae и Pseudomonas aeruginosa, служит прогностически неблагоприятным признаком [5]. Это связано с высоким уровнем устойчивости к антибиотикам К. pneumoniae и P. aeruginosa [5]. При этом наличие резистентности к бета-лактамам и фторхинолонам делает невозможным назначение пролонгированной этиотропной антибактериальной терапии, которая является стандартной для лечения инфекции костей и суставов ввиду отсутствия других пероральных препаратов, активных в отношении грамотрицательных патогенов.
Бактериофаги, воздействуя на сессильные бактерии, способны разрушать и/или предотвращать образование биопленки путем проникновения в ее структуру по водным каналам. Установлено, что большинство фагов продуцируют деполимеразы, способные гидролизовать компоненты матрикса бактериальных биопленок [1][6][7].
Цель исследования – оценить чувствительность К. pneumoniae и P. aeruginosa к препарату поливалентного бактериофага (ПБФ) и его влияние на биопленкообразование и сформированную биопленку изолятов, выделенных от пациентов с ортопедической инфекцией.
Материалы и методы
Исследование носило проспективный характер, в него включали клинические штаммы, выделенные подряд из биоматериала пациентов с перипротезной инфекцией и/или остеомиелитом в 2021 г. Всего протестировано 100 клинических изолятов: K. pneumoniae – 50, P. aeruginosa – 50. Выделение культур проводили в соответствии со стандартными ручными методиками, принятыми в лаборатории. Материалом для исследования служили тканевые биоптаты, раневое отделяемое, синовиальная жидкость и удаленные металлоконструкции, полученные от пациентов, находящихся на стационарном лечении. Видовую идентификацию выполняли методом MALDI-TOF-MS с использованием системы FlexControl и программного обеспечения MBT Compass 4.1 (Bruker Daltonics, Германия), Score ≥ 2,0. Чувствительность изолятов к антибактериальным препаратам изучали в соответствии с требованиями EUCAST v.21.
Бактериальную ДНК выделяли с использованием набора «ДНК-Сорб-АМ», согласно инструкции производителя (ФБУН ЦНИИЭ, Россия). Детекцию генов приобретенных карбапенемаз групп KPC/OXA-48 иметалло-бета-лактамаз осуществляли методом Real-time PCR (ПЦР-РВ) с использованием наборов реагентов с гибридационно-флуоресцентной детекцией «АмплиСенс MDR KPC/OXA-48-FL» и «АмплиСенс MDR MBL-FL» («Интерлабсервис», Россия) на приборе «Амплификатор Real-time CFX96 Touch» (BioRAD, США).
Наличие чувствительности к препарату «Секстафаг» пиобактериофаг поливалентный («Микроген», Россия) определяли на мясо-пептонном агаре (МПА). Бактериальную взвесь (0,5 по МсF) ватным тампоном наносили на МПА и через 10 минут на поверхность агара дозатором наносили 10 мкл ПБФ в дубликатах. Чашки инкубировали при 37 °С 18 часов (рис. 1).
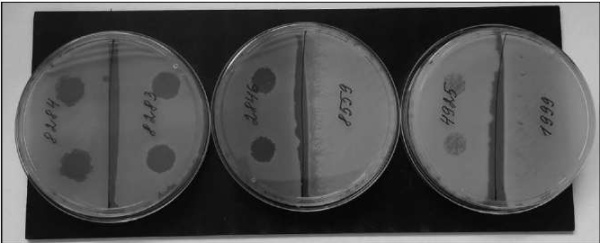
Рис. 1. Результаты определения чувствительности P. aeruginosa к препарату поливалентного бактериофага (ПБФ). Наличие зоны подавления роста культуры на МПА в месте нанесения капли у чувствительных к фагу штаммов.
Антибактериальное действие ПБФ в отношении эталонных штаммов K. pneumoniae ATCC 33495 и P. aeruginosa ATCC 27853 оценивали путем построения кинетических кривых роста. В 4 лунки 96-луночного планшета вносили 125 мкл бульона Мюллера–Хинтона (МХБ), 125 мкл ПБФ и 20 мкл бактериальной взвеси (1×105 KOE/мл). В контрольные лунки вносили только 250 мкл МХБ и взвесь бактерий (20 мкл). Планшеты инкубировали при 37 °С 18 часов в спектрофотометре Spectrostar Nano (BMG, Германия). Исследование включало 20 циклов по 3600 секунд, OD600. Анализ полученных кривых проводили в программе Spectrostar Nano Mars.
Биопленки чувствительных к бактериофагам штаммов формировали по методу O’Toole. В 4 лунки плоскодонного планшета вносили по 125 мкл питательной среды LB, 125 мкл ПБФ и 20 мкл бактериальной взвеси (1×108 KOE/мл). В контрольные лунки вносили только питательную среду и взвесь бактерий. Планшеты инкубировали 24 часа при 37 °С, затем промывали, высушивали и окрашивали 0,1% раствором генцианвиолета с последующей спиртовой экстракцией. Биомассу сформированных пленок оценивали по оптической плотности (ОП) полученных экстрактов красителя при 570 нм. Степень биопленкообразования оценивали в соответствии с критериями Stepanoviс, 2014. Процентное ингибирование биопленкообразования рассчитывали, используя методику Kumari, 2020.
Биопленки формировали по методу O’Toole. Планшеты инкубировали 24 часа при 37 °С, затем промывали, высушивали и опытные лунки обрабатывали 200 мкл ПБФ (контрольные – LB-бульон). Через 24 часа лунки промывали, высушивали и окрашивали 0,1% раствором генцианвиолета с последующей спиртовой экстракцией (96% этанол). Биомассу пленок оценивали по оптической плотности полученных экстрактов при 570 нм (Spectrostar Nano).
Полученные данные анализировали с использованием программы Statistica (v.13). Оценку нормальности распределения значений выполняли тестом Шапиро – Уилка (W-тест), а сравнение количественных показателей – при помощи t-критерия Стьюдента. Различия считали статистически значимыми при р < 0,05.
Результаты исследования
Типовые штаммы K. pneumoniae ATCC 33495 и P. aeruginosa ATCC 27853 характеризовались чувствительностью к бактериофагам (рис. 2), о чем свидетельствует статистически значимое снижение оптической плотности МХБ со взвесью бактерий при совместной инкубации с бактериофагами (р < 0,001).
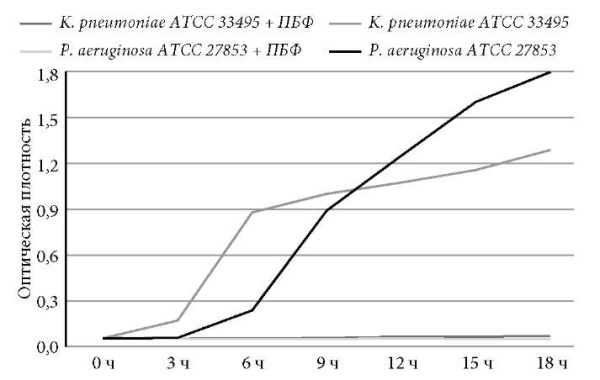
Рис. 2. Динамика роста биомассы типовых штаммов в течение 18 часов в присутствии ПБФ и в питательной среде без препарата (единицы оптической плотности).
Среди изученных 50 клинических культур K. pneumoniae 7 штаммов (14%) характеризовались устойчивостью к карбапенемам. Для 6 карбапенем-резистентных K. pneumoniae регистрировали наличие гена металло-бета-лактамаз группы NDM (blaNDM), при этом один изолят продуцировал и сериновые карбапенемазы OXA-48 (blaOXA-48). Из 50 изолятов P. aeruginosa – 15 (30%) демонстрировали резистентность к кабапенемам, из них 4 были продуцентами VIM-карбапенемаз (blaVIM).
Доля чувствительных к бактериофагам штаммов K. pneumoniae составила 36% (18 из 50), в том числе 1 карбапенем-резистентный изолят – продуцент NDM-карбапенемазы. Штаммы P. aeruginosa были чувствительны к фагам в 56% случаев (28 из 50) (рис. 2), включая 3 из 15 карбапенем-резистентных штамма, при этом для данных культур не выявлено наличие генов VIM-карбапенемаз.
Сравнительный анализ активности фагов в отношении штаммов P. aeruginosa с различным профилем антибиотикочувствительности показал, что среди 35 чувствительных к карбапенемам изолятов 69% были чувствительны и к бактериофагам. В тоже время фаги были эффективны лишь в отношении 20% карбапенем-устойчивых культур.
Все фагочувствительные изоляты K. pneumoniae (n = 18) и P. aeruginosa (n = 28) характеризовались биопленкообразующей способностью различной степени (рис. 3).

Рис. 3. Распределение штаммов К. pneumoniae и P. aeruginosa по степени биопленкообразующей способности.
Подавляющее большинство штаммов K. pneumoniae обладали слабой способностью формировать биопленки – 83%. Все культуры P. aeruginosa демонстрировали умеренную степень биопленкообразования.
ПБФ ингибировал формирование биопленок у 83 и 96% изолятов K. pneumoniae и P. aeruginosa соответственно (рис. 4). При этом снижение биомассы биопленок более чем на 80% было зарегистрированодля 11% культур K. pneumoniae и 61% – P. aeruginosa. Следует отметить, что для карбапенем-резистентного штамма K. pneumoniae не выявлено ингибирование биопленкообразования в присутствии бактериофага. Совместная инкубация фагов и устойчивых к карбапенемам P. aeruginosa приводила к замедлению формирования биопленки на 84%.
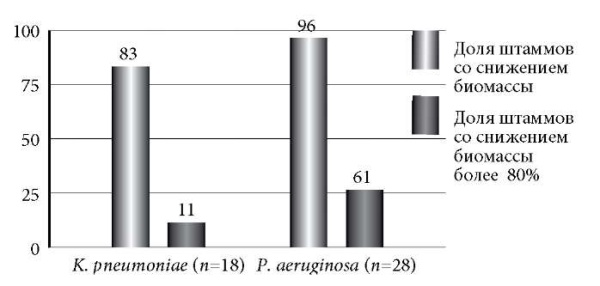
Рис. 4. Активность ПБФ в отношении ингибирования биопленкообразования К. pneumoniae и P. aeruginosa.
ПБФ снижал биомассу сформированной суточной биопленки у 78% изученных изолятов K. pneumoniae и 68% – P. aeruginosa, однако деструкция пленки более чем на 80% была выявлена лишь у 4 и 6% штаммов соответственно (рис. 5). При этом для карбапенем-резистентных P. aeruginosa снижение биомассы сформированных пленок относительно контроля составило в среднем 30%, а для NDM-продуцирующего изолята K. pneumoniae – 40%.
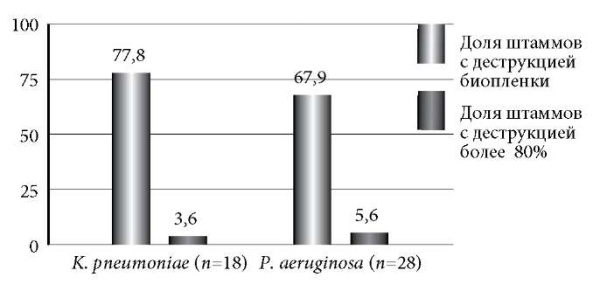
Рис. 5. Доля штаммов К. pneumoniae и P. aeruginosa со снижением биомассы суточных биопленок после обработки ПБФ в течение 24 часов.
Обсуждение полученных данных
Антибактериальный эффект препаратов бактериофагов обусловлен внедрением генома фага в бактериальную клетку с последующим его размножением и лизисом инфицированной клетки [6]. Вышедшие во внешнюю среду в результате лизиса бактериофаги повторно инфицируют и повреждают другие бактериальные клетки, действуя до полного уничтожения патогенов в очаге воспаления [6][7]. Д.В. Тапальский исоавт. [8][9] показали, что чувствительными к препарату «Секстафаг» были 24,1% клинических изолятов P. aeruginosa и 24,8% штаммов K. pneumoniae. Авторы установили, что уровень литической активности препаратов бактериофагов в 1,3–2,6 раза ниже в отношении экстремально резистентных к антибиотикам изолятов P. aeruginosa в сравнении с чувствительными. В нашем исследовании чувствительностью к ПБФ характеризовались 36% штаммов K. pneumoniae и 56% P. aeruginosa. В отношении карбапенем-устойчивых штаммов K. pneumoniae и P. aeruginosa активность бактериофагов составила 14 и 20% соответственно.
Взаимодействие фагов с бактериальной клеткой на различных этапах биопленкообразования включает предотвращение бактериальной адгезии и колонизации, замедление роста и созревания биопленки. Этот эффект дополняет антибактериальное действие в отношении патогенов, приводящее к увеличению числа фагов внутри биопленки [10]. Бактериофаги способны проникать в биопленки, образованные штаммамис различной степенью восприимчивости к вирусам и способностью к биопленкообразованию [11]. Причем в более 50% случаев фаги эффективно препятствуют формированию биопленки P. aeruginosa [12]. В соответствии с нашими результатами большинство фагочувствительных культур P. aeruginosa замедляли биопленкообразование в присутствии ПБФ. Для 61% изолятов это снижение составило более 80% по сравнению с контролем. При этом меньший эффект был зарегистрирован в отношении формирования биопленок K. pneumoniae.
Вследствие низкой эффективности антибиотикотерапии инфекций, связанных с формированием биопленок, возрастает интерес к фагам в качестве перспективных средств для эрадикации возбудителей, находящихся в ее составе. Бактерии, расположенные в более глубоких слоях, в условиях крайне ограниченного доступа кислорода и питательных веществ замедляют свою метаболическую активность, что снижает эффективность большинства антибиотиков и ведет к низкой репликации фагов [1][6]. Результаты выполненного исследования показали снижение биомассы суточных биопленок под действием ПБФ у78 и 68% клинических изолятов K. pneumoniae и P. aeruginosa соответственно, однако деструкцию пленки выше 80% регистрировали лишь у нескольких штаммов каждого вида. Известно, что бактериофаг vB_KpnP_FZ12 разрушал структуру биопленки и кластеров K. pneumoniae, а также сокращал общее число бактерий в биопленке [13]. S.A. Fong и соавт. [14] использовали бактериофаги для эрадикации биопленок P. aeruginosa, выделенных от пациентов с хроническим риносинуситом [14]. Авторы установили, что препараты отдельных фагов уменьшали биомассу биопленок изолятов на 53–73%, а применение фагового «коктейля» – на 89%. При этом множественная лекарственная устойчивость P. aeruginosa не влияла на антибиопленочную активность всех четырех фагов [14]. В нашем исследовании обнаружено ингибирование биопленкообразования карбапенем-резистентных штаммов P. aeruginosa под действием ПБФ.
Заключение
Коммерческий препарат поливалентного пиобактериофага был активен в отношении 36 и 56% штаммов K. pneumoniae и P. aeruginosa соответственно, включая 1 из 6 и 4 из 15 карбапенем-устойчивых изолятов. Большинство изученных штаммов обоих видов бактерий снижали продукцию биопленок при совместной инкубации с поливалентным фагом, однако снижение биомассы более 80% выявлено для P. aeruginosa. Воздействие бактериофага на уже сформированные биопленки было менее выраженным, несмотря на снижение биомассы биопленок у 78 и 68% штаммов K. pneumoniae и P. aeruginosa соответственно. Полученные результаты свидетельствуют о перспективности дальнейших исследований, посвященных изучению активности бактериофагов в отношении возбудителей ортопедической имплантат-ассоциированной инфекции, и разработки методов фаготерапии для лечения профильных пациентов.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Источник финансирования. Авторы заявляют об отсутствии внешнего финансирования при проведении исследования.
Список литературы
1. Gordillo Altamirano FL, Barr JJ. Phage therapy in the postantibiotic era. Clin Microbiol Rev. 2019;32(2):e00066-18. doi: 10.1128/CMR.00066-18
2. Patey O, McCallin S, Mazure H, Liddle M, Smithyman A, Dublanchet A. Clinical indications and compassionate use of phage therapy: personal experience and literature review with a focus on osteoarticular infections. Viruses. 2018;11(1):18. doi: 10.3390/v11010018
3. Antimicrobial Resistance Collaborators. Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis. Lancet. 2022;399(10325):629–55. doi: 10.1016/S01406736(21)02724-0
4. Ландышев Н.Н., Воронько Я.Г., Тимошина О.Ю., Суслина С.Н., Акимкин В.Г., Мирошников К.А. Обзор законодательства в области обращения персонализированных препаратов бактериофагов. Вопросы вирусологии. 2020;65(5):259–66. doi: 10.36233/0507-4088-2020-65-5-2
5. Bozhkova S, Tikhilov R, Labutin D, Denisov A, Shubnyakov I, Razorenov V, Artyukh V, Rukina A. Failure of the first step of two-stage revision due to polymicrobial prosthetic joint infection of the hip. J Orthop Traumatol. 2016;17(4):369–76. doi: 10.1007/s10195-016-0417-8
6. Harper DR, Parracho HMRT, Walker J, Sharp R, Hughes G, Werthén M, Lehman S, Morales S. Bacteriophages and biofilms. Antibiotics (Basel). 2014;3(3):270–84. doi: 10.3390/antibiotics3030270
7. Hemmati F, Rezaee MA, Ebrahimzadeh S, Yousefi L, Nouri R, Kafil HS, Gholizadeh P. Novel strategies to combat bacterial bio-films. Mol Biotechnol. 2021;63(7):569–86. doi: 10.1007/s12033-021-00325-8
8. Тапальский Д.В. Чувствительность госпитальных изолятов Pseudomonas aeruginosa к препаратам для фаготерапии. Вестник витебского государственного медицинского университета. 2018;17(2):47–54. doi: 10.22263/2312-4156.2018.2.47
9. Тапальский Д.В., Козлова А.И. Чувствительность к препаратам бактерирофагов клинических изолятов Klebsiella pneumoniae с различными уровнями антиби отикорезистентности. Проблемы здоровья и экологии. 2018;(1):56–62. doi: 10.51523/2708-6011.2018-15-1-9
10. Łusiak-Szelachowska M, Weber-Dąbrowska B, Górski A. Bacteriophages and lysins in biofilm control. Virol Sin. 2020;35(2):125–33. doi: 10.1007/s12250-019-00192-3
11. González S, Fernández L, Gutiérrez D, Campelo AB, Rodríguez A, García P. Analysis of different parameters affecting diffusion, propagation and survival of staphylophages in bacterial biofilms. Front Microbiol. 2018;9:2348. doi: 10.3389/fmicb.2018.02348
12. Асланов Б.И., Зуева Л.П., Долгий А.А., Конев С.Д., Гришко Т.А. Эффективность применения бактериофагов против штаммов Pseudomonas aeruginosa, формирующих микробные биопленки. Профилактическая и клиническая медицина. 2020;4(77):40–5. doi: 10.47843/2074-9120_2020_4_40
13. Глазунов Е.А., Зубаров Ф.М., Павлова И.В., Толмачева Г.С. Воздействие вирулентными бактериофагами на биопленки Klebsiella pneumoniae. Проблемы ветеринарной санитарии, гигиены и экологии. 2020;4(36):480–5. doi: 10.36871/vet.san.hyg.ecol.202004012
14. Fong SA, Drilling A, Morales S, Cornet ME, Woodworth BA, Fokkens WJ, Psaltis AJ, Vreugde S, Wormald PJ. Activity of bacteriophages in removing biofilms of Pseudomonas aeruginosa isolates from chronic rhinosinusitis patients. Front Cell Infect Microbiol. 2017;7:418. doi: 10.3389/fcimb.2017.00418.
Об авторах
Е. М. ГординаРоссия
Гордина Екатерина Михайловна – канд. мед. наук, старший научный сотрудник отделения профилактики и лечения раневой инфекции
195427, г. Санкт-Петербург, ул. Академика Байкова, 8
С. А. Божкова
Россия
Санкт-Петербург
Л. Н. Смирнова
Россия
Санкт-Петербург
Рецензия
Для цитирования:
Гордина Е.М., Божкова С.А., Смирнова Л.Н. Антибактериальное и антибиопленочное действия бактериофагов в отношении Klebsiella pneumoniae и Pseudomonas aeruginosa, выделенных от пациентов с ортопедической инфекцией. Тихоокеанский медицинский журнал. 2023;(1):59-63. https://doi.org/10.34215/1609-1175-2023-1-59-63
For citation:
Gordina E.M., Bozhkova S.A., Smirnova L.N. Anti-bacterial and anti-biofilm activity of bacteriophages against Klebsiella pneumoniae and Pseudomonas aeruginosa isolated from orthopedic patients. Pacific Medical Journal. 2023;(1):59-63. (In Russ.) https://doi.org/10.34215/1609-1175-2023-1-59-63





































