Перейти к:
Моделирование процессов меж- и внутривидового взаимодействия микроорганизмов в эксперименте на периодической культуре
https://doi.org/10.34215/1609-1175-2023-3-9-14
Аннотация
Цель: демонстрация возможностей использования периодической культуры для изучения процессов взаимодействия микроорганизмов на модели ведущих в современный период в этиологии сальмонеллеза серотипов Salmonella Enteritidis и S. Typhimurium в формируемой ими микробной ассоциации в эксперименте in vitro как между собой, так и в сочетании с Yersinia pseudotuberculosis и Shigella flexneri.
Материалы и методы. Экспериментальную модель ассоциаций in vitro создавали путем совместного культивирования штаммов разных микроорганизмов на LB-бульоне. В работе использованы штаммы сальмонелл и Yersinia pseudotuberculosis, хранящиеся в музее НИИ эпидемиологии и микробиологии им. Г.П. Сомова при температуре -80 °С. Наблюдение за поведением ассоциации проводили в течение 24 ч при 37 °C на качалке. В качестве контроля были изучены кривые роста всех взятых в разработку штаммов в монокультуре. На первом этапе исследований проводили сокультивирование S. Enteritidis и S. Typhimurium; на втором – к эксперименту подключили штаммы Yersinia pseudotuberculosis и Shigella flexneri – эталонный штамм АТСС 12022.
Результаты. В контрольном эксперименте рост испытуемых культур был довольно похож, тогда как в ассоциации при смешении S. Typhimurium существенно опережала в росте S. Enteritidis. Аналогичное исследование, проведенное с тремя патогенами, также позволило установить, что при росте в монокультуре существенных различий в темпах роста между ними не было выявлено, тогда как в ассоциации рост Y. pseudotuberculosis значительно подавлялся с самого начала наблюдения в течение первого часа. В этих условиях доминирующее положение заняла S. Enteritidis.
Заключение. В итоге наши исследования свидетельствуют о том, что в периодической культуре можно изучать процессы взаимодействия как между различными видами микроорганизмов, так и их внутривидовые взаимоотношения. Как мы полагаем, полученные результаты взаимодействия в определенной мере могут быть объяснены одним из основных кинетических принципов экологии – принципа конкурентного исключения Гаузе, который утверждал невозможность сосуществования двух видов в одной экологической нише при конкуренции за источник питания.
Для цитирования:
Яковлев А.А., Раков А.В., Показеева Ю.Н., Щелканов М.Ю. Моделирование процессов меж- и внутривидового взаимодействия микроорганизмов в эксперименте на периодической культуре. Тихоокеанский медицинский журнал. 2023;(3):9-14. https://doi.org/10.34215/1609-1175-2023-3-9-14
For citation:
Yakovlev A.A., Rakov A.V., Pokazeeva Yu.N., Shchelkanov M.Yu. Modeling inter- and intraspecific interaction of microorganisms in a batch culture experiment. Pacific Medical Journal. 2023;(3):9-14. (In Russ.) https://doi.org/10.34215/1609-1175-2023-3-9-14
В настоящие время как в нашей стране, так и за рубежом [1–8] активно изучаются процессы взаимоотношения между микроорганизмами. Эта тема имеет как фундаментальное, так и практическое значение в первую очередь для медицины. Понимание механизмов коммуникации и конкуренции между микроорганизмами поможет выработать новые стратегии в борьбе с инфекционными заболеваниями.
Моделирование сообществ является необходимым этапом для понимания деятельности микроорганизмов в их естественной среде обитания. Однако в настоящий период каких-либо универсальных методик по изучению процессов взаимодействия не выработано. Поэтому, как правило, указанные процессы рассматриваются на моделях, предназначенных для изучения монокультур микроорганизмов.
Как показывают исследования по данной проблеме, экспериментальное изучение взаимодействия микробных (бактериальных) популяций, во-первых, можно проводить in vitro путем наблюдения за их развитием в периодических или хемостатных культурах [9]. Вовторых, к настоящему времени получены многочисленные данные, свидетельствующие о способности микроорганизмов к обитанию как в разных условиях окружающей среды, так и в организме хозяина, в виде биопленок [6][10]. Последние также можно использовать для изучения процессов взаимодействия между микроорганизмами [11]. В настоящей работе представлен опыт наших исследований по моделированию межбактериального взаимодействия в периодической культуре, поскольку мы занимаемся этим направлением с середины 1990-х годов.
Цель исследования: демонстрация возможностей использования периодической культуры для изучения процессов взаимодействия микроорганизмов. Цель первого этапа исследований – изучение внутривидового взаимодействия между двумя ведущими в современный период в этиологии сальмонеллеза серотипами Salmonella enterica subsp. enterica серотип Enteritidis (S. Enteritidis) и Salmonella enterica subsp. enterica серотип Typhimurium (S. Typhimurium) в формируемой ими микробной ассоциации в эксперименте in vitro как между собой, так и в сочетании с Yersinia pseudotuberculosis и Shigella flexneri.
Материалы и методы
Штаммы микроба. Salmonella enterica и Yersinia pseudotuberculosis – актуальные бактериальные патогены, формирующие вспышки инфекций, в основном пищевого характера. Принимая во внимание накопленный опыт работы с этими микроорганизмами в лаборатории молекулярной эпидемиологии НИИ эпидемиологии и микробиологии им. Г.П. Сомова и большой выбор объектов исследования в музейной коллекции института, эти виды были нами отобраны в качестве моделей для их изучения в микробной ассоциации при наблюдении в периодической культуре.
В работе использованы следующие штаммы сальмонелл: S. Enteritidis S-118 (с плазмидной массой 38 MDa), S-26292 (38 MDa) и S-26895 (38:1,4 MDa), S. Typhimurium S-23513 (60 MDa) и S-18187 (не содержащий плазмид). Все штаммы хранились в музее НИИ эпидемиологии и микробиологии им. Г.П. Сомова при температуре -80 °С. Необходимо отметить, что плазмиды с молекулярной массой 38 MDa и 60 MDa являются плазмидами вирулентности pSEV и pSTM для S. Enteritidis и S. Typhimurium соответственно.
Модель исследования ассоциации S. enterica в периодической культуре
Экспериментальную модель ассоциаций in vitro создавали путем их совместного культивирования на LBбульоне. Для исследования бактерии предварительно выращивали до изолированных колоний на чашках Петри с питательным агаром (рН 7,2–7,3). Образцы культивировали при 37 °С. Затем штаммы высевали на LB-бульон (рН 7,2–7,3) и выращивали на качалке при 37 °C в течение 18 ч. Спектрофотометрическим методом оптическую плотность (OD при 600 нм) штамма с бóльшим ростом доводили до оптической плотности штамма с меньшим ростом путем разведения LB-бульоном. Для опыта две исследуемые культуры сальмонелл смешивали в равных количествах путем внесения в LB-бульон из расчета 1 мкл каждой бактерии на 1000 мкл среды. Наблюдение за поведением ассоциации проводили в течение 24 ч при 37 °C на качалке. Смеси культур в определенные промежутки времени (через 1, 3, 6 и 24 ч после смешивания) высевали по 100 мкл на чашки Петри с питательным агаром с учетом необходимых разведений (от 10-6 до 10-11) до появления изолированных колоний. Культуры бактерий инкубировали при 37 °C в течение 18 ч. Прирост бактериальной массы определяли по количеству колониеобразующих клеток, выросших на среде. Случайным образом отбирали 16 изолированных колоний из разных секторов чашки, сеяли на скошенный питательный агар (рН 7,2–7,3) и инкубировали при 37 °C в течение 18 ч.
При смешивании серотипов S. Enteritidis и S. Typhimurium на следующие сутки после инкубации полученные вышеописанным способом культуры серотипировали в реакции агглютинации на стекле с помощью сывороток диагностических сальмонеллезных адсорбированных «Петсал» (ФГУП СПбНИИВС) на наличие соответствующего одному из двух серотипов О-антигена (О:9 для S. Enteritidis и O:4 для S. Typhimurium) и подсчитывали процент колоний соответствующего серотипа.
При смешивании разных плазмидных типов серотипа S. Enteritidis на следующие сутки после инкубации полученные описанным выше образом культуры исследовали в плазмидном анализе по методике C.L. Kado и S.T. Liu [12] для установления плазмидного спектра и подсчитывали процент колоний соответствующего плазмидного типа.
Было проведено по три независимых эксперимента для каждой ассоциации. Высчитывали средний процент колоний соответствующего серотипа или плазмидного типа через 1, 3, 6 и 24 ч после смешивания штаммов.
Важно подчеркнуть, что в доступной литературе мы встретили в основном изучения процессов сокультивирования в виде бикультур. Поэтому на следующем этапе наших исследований мы провели аналогичное исследование с тремя патогенами, предварительно изучив рост штаммов как монокультур в качестве контроля, дополнительно используя в данном эксперименте возбудителей Y. pseudotuberculosis и Shigella flexneri [Shigella flexneri sv 2b Gp B – эталонный штамм АТСС 12022 (производитель Remel Europe, Ltd, UK)].
Статистическую обработку всего массива полученных результатов проводили общепринятыми методами в программе Microsoft Excel 2010.
Результаты исследования
В качестве контроля нами первоначально были изучены кривые роста взятых в разработку штаммов сальмонелл в монокультуре (контроль роста). Результаты представлены на рис. 1.
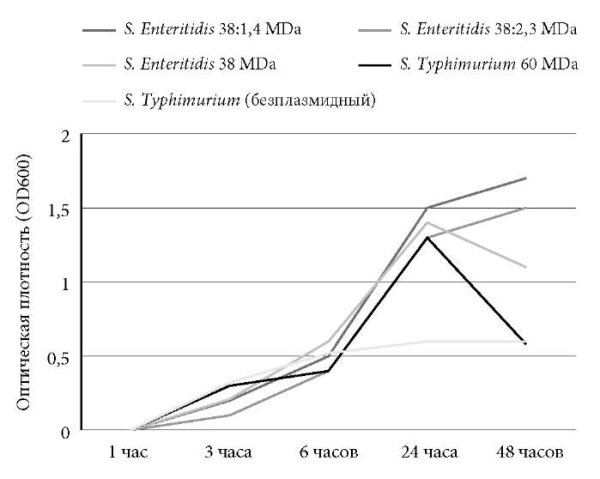
Рис. 1. Рост исследуемых штаммов S. Enteritidis и S. Typhimurium
в монокультуре при культивировании in vitro
в LB-бульоне при температуре 37 °С (контроль роста).
Как видно на рисунке, все штаммы росли в LBбульоне в течение 6 часов (время наблюдения) схожим образом, и тенденции кривых роста в основном отличались друг от друга в пределах статистической погрешности. Тем не менее наименьшая интенсивность роста отмечена у S. Enteritidis, не имеющей плазмиды. А рост S. Typhimurium с плазмидой 60 MD, в отличие от других испытуемых штаммов, перешел к фазе отмирания уже через 24 часа эксперимента.
Экспериментальную модель ассоциаций in vitro создавали путем совместного культивирования испытуемых штаммов на LB-бульоне. Результаты исследования штаммов сальмонелл, содержащих плазмиды вирулентности: S. Enteritidis S-26292 c pSEV (массой 38 MDa) и S. Typhimurium S-23513 с pSTM (массой 60 MDa) показали, что через 1 ч после смешивания скорость роста культур была примерно одинакова, при этом число колоний S. Enteritidis незначительно превышало число колоний S. Typhimurium (55 и 45%) (рис. 2).
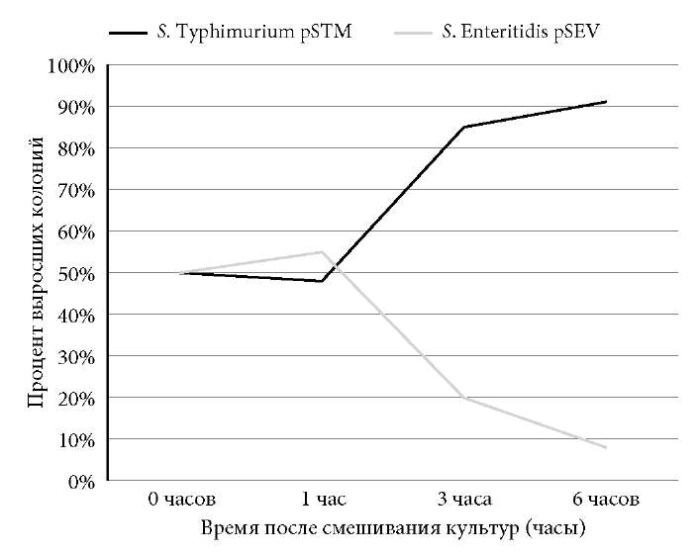
Рис. 2. Рост штаммов S. Enteritidis и S. Typhimurium,
содержащих плазмиды вирулентности,
при совместном культивировании in vitro.
Но уже через 3 ч после смешивания S. Typhimurium значительно опережала росте S. Enteritidis (83% против 17%), а через 6 ч частота выделения S. Typhimurium достигала 92%. Важно подчеркнуть, что переход к фазе отмирания в опыте для S. Enteritidis наступил гораздо раньше, чем в контроле.
На следующем этапе исследования нами было прослежено возможное влияние плазмиды вирулентности на бóльшую конкурентоспособность к росту в LBбульоне S. Typhimurium по сравнению с S. Enteritidis. Для этого с использованием ранее описанной методики изучали микробную ассоциацию S. Enteritidis S-26292 с плазмидой вирулентности массой 38 MDa (pSEV) и S. Typhimurium S-18187, не содержащей плазмид. Через 1 ч после смешивания двух штаммов культуры росли примерно с одинаковой скоростью (54% S. Typhimurium и 46% S. Enteritidis) (рис. 3).
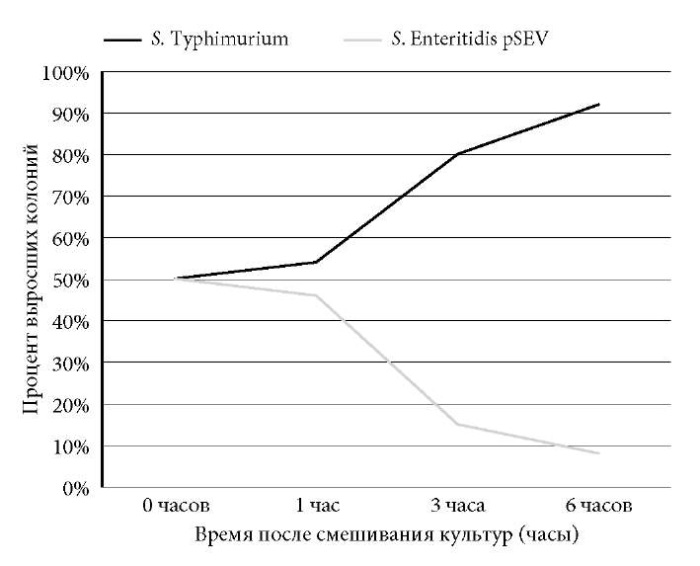
Рис. 3. Рост штаммов S. Enteritidis, содержащей плазмиду вирулентности,
и бесплазмидной S. Typhimurium при совместном культивировании in vitro.
Однако через 3 ч количество колоний S. Typhimurium, как и в контроле, возросло до 82%, тогда как S. Enteritidis снизилось до 18%. Через 6 ч доля S. Typhimurium уже составила 93%.
Полученные результаты были близки к таковым на первом этапе исследования и показали, что наличие или отсутствие плазмиды вирулентности у S. Typhimurium никак не влияет на ее способность к доминированию при сокультивировании с S. Ente riti dis в условиях in vitro. Вместе с тем необходимо отметить, что даже после 6 ч совместного роста можно было обнаружить S. Enteritidis, но ее присутствие не превышало 10% от общего числа колоний. По этой причине на следующем этапе эксперимента дополнительно исследовали колонии, полученные через 24 часа сокультивирования. Так, наблюдение за микробной ассоциацией S. Enteritidis двух разных плазмидных типов показало, что в условиях Enteritidis плазмидного типа 38:1,4 MDa, опережая ее рост, тогда как при наблюдении в монокультуре размножение S. Enteritidis плазмидного типа 38:1,4 MDa явно доминировало. Популяции S. Enteritidis плазмидных типов 38 MDa и 38:1,4 MDa развивались параллельно лишь в течение 1-го часа (рис. 4).
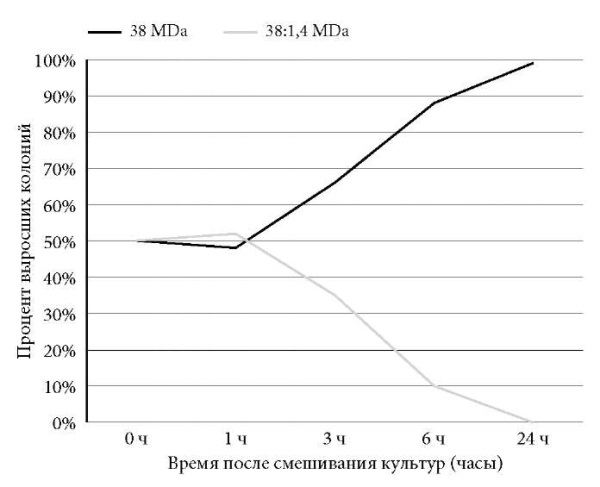
Рис. 4. Рост штаммов S. Enteritidis,
содержащей плазмиду вирулентности массой 38 MDa,
и S. Enteritidis, содержащей плазмиду вирулентности массой 38 MDa
с криптической плазмидой массой 1,4 MDa, при совместном культивировании in vitro.
В дальнейшие часы наблюдения S. Enteritidis плазмидного типа 38 MDa постоянно опережала S. Enteritidis плазмидного типа 38:1,4 MDa по динамике роста. Концентрация S. Enteritidis плазмидного типа 38 MDa в среде через 6 ч достигала 87% от общего количества бактерий, а через 24 ч – 100%.
На следующем этапе наших исследований мы провели аналогичный эксперимент с тремя патогенами, предварительно изучив рост штаммов как монокультур в качестве контроля (рис. 5), дополнительно используя в данном исследовании возбудителей Y. pseudotuberculosis и Shigella flexneri.
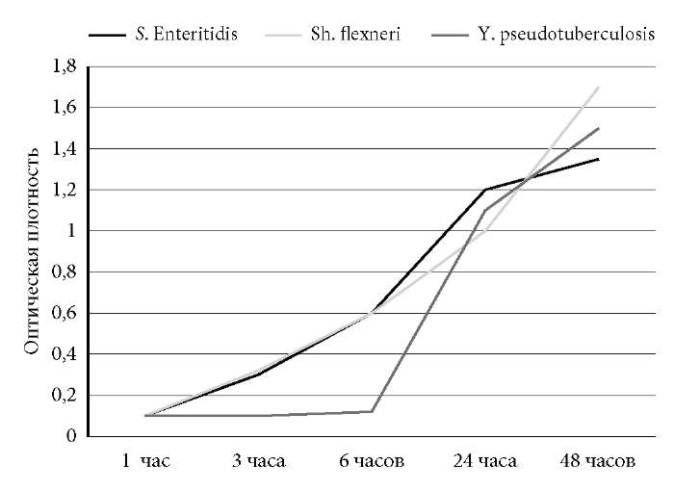
Рис. 5. Кривые роста штаммов энтеробактерий:
S. Enteritidis, S. flexneri и Y. pseudotuberculosis
в монокультуре в LB-бульоне при температуре 37 °С (контроль роста).
Как видно на рис. 5, весь период наблюдения испытуемые культуры росли примерно с одинаковой скоростью в монокультуре, тогда как в мультивидовой культуре (опыт) рост иерсинии значительно подавлялся с самого начала наблюдения в течение первого часа (рис. 6).
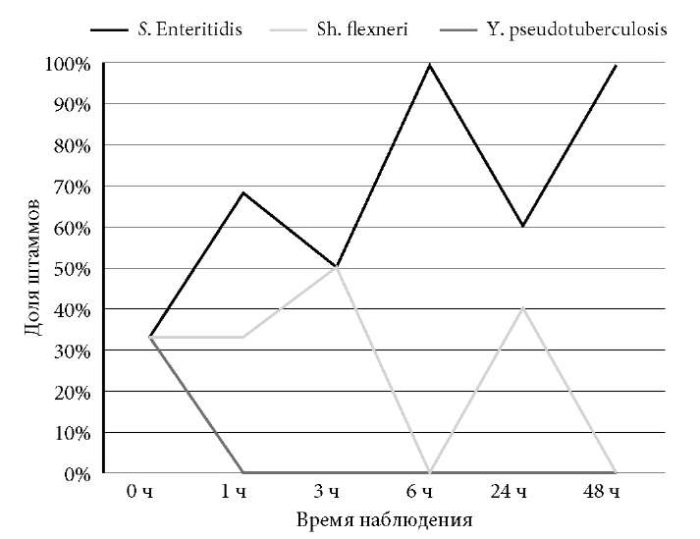
Рис. 6. Доля штаммов разных энтеробактерий
при сокультивировании S. Enteritidis, Sh. filexneri и Y. pseudotuberculosis
в микст-культуре в LB-бульоне при температуре 37 °С.
Важно отметить, что в опыте кривые, отражающие рост культур сальмонеллы и шигеллы, не совпадали в динамике. В представленной мультивидовой культуре доминировала сальмонелла (рис. 6), при этом увеличение активности роста S. Enteritidis в определенный период эксперимента сопровождался снижением интенсивности роста шигеллы, и наоборот. Как мы полагаем, такая динамика позволяет данным микроорганизмам более эффективно использовать ограниченные ресурсы питательных веществ в используемой для роста среде. Отсутствие роста Y. pseudotuberculosis при сокультивировании с двумя другими патогенами, возможно обусловлено субоптимальными условиями культивировании этого психрофильного микроба, поскольку оптимальной температурой роста для него является комнатная температура (20 °С).
Обсуждение полученных данных
Проведенные исследования показали, что стратегия развития испытуемых микроорганизмов существенно отличается при росте в монокультуре и в виде ассоциаций при сокультивировании. При этом не отмечено одинаковой выраженности в скорости роста тех или иных микроорганизмов в моно- и поликультуре. Надо полагать, что при взаимодействии микробов при сокультивировании реализуются интеграционно-конкурентные взаимоотношения между ними [2],
что позволяет в ограниченных питательными ресурсами периодической культуре одному из микроорганизмов добиваться конкурентного преимущества, обеспечивающего его жизнеспособность за счет использования питательных веществ, предназначенных для всех культивируемых в данной питательной среде микроорганизмов. В частности, представленные результаты исследования свидетельствуют о том, что S. Enteritidis и S. Typhimurium связаны конкурентными взаимоотношениями и этот механизм является ведущим в процессе их саморегуляции в микробиоценозе. Но в естественной среде в современный период в большинстве регионов доминирует S. Enteritidis, тогда как в условиях нашего эксперимента – S. Typhimurium. Причины несоответствия остаются пока неясными. Возможно, на результатах эксперимента сказываются штаммовые различия S. Enteritidis и S. Typhimurium, примененных в эксперименте и циркулирующих в естественной среде.
В итоге наши исследования свидетельствуют о том, что в периодической культуре можно изучать процессы взаимодействия как между различными видами микроорганизмов, так и их внутривидовые взаимоотношения. При этом процессы роста испытуемых культур при монокультивировании и сокультивировании значительно различались. В частности, полученные результаты показали, что в процессе совместного роста штаммов в периодической бикультуре наблюдается «эффект экзальтации», который выражается в быстром росте обоих видов в первый час эксперимента и последующим замещением одного, более приспособленного вида другим. Такое замещение нельзя назвать полным, поскольку существует вероятность перехода менее приспособленного вида в некультивируемое состояние – дормантную форму существования (метаболически неактивные, некультивируемые клетки прокариот, VNBC) [13].
Как мы полагаем, все вышеописанные процессы взаимодействия в определенной мере могут быть объяснены одним из основных кинетических принципов экологии – принципа конкурентного исключения Гаузе [14], который утверждал невозможность сосуществования двух видов в одной экологической нише
при конкуренции за источник питания. Дальнейшее изучение возможных взаимоотношений между микроорганизмами, вовлеченными в инфекцию, а также механизмов этого взаимодействия имеет решающее значение в понимании процессов, идущих на суборганизменном уровне эпидемического процесса и их отражения на популяционном [3][4].
Выводы
- Рост S. Enteritidis и S. Typhimurium в монокультуре, развиваясь с одинаковым темпом в течение первых 6 часов наблюдения, в последующие (24 и 48 ч) стал существенно отличаться по темпам и фазе развития в периодической культуре в зависимости от серотипа и принадлежности к тем или иным плазмидным типам.
- Наличие или отсутствие плазмиды вирулентности у S. Typhimurium не повлияло на ее доминирование при сокультивировании с S. Enteritidis.
- В условиях обитания в LB-бульоне S. Enteritidis плазмидного типа 38 MDa при сокультивировании подавляла рост и размножение Enteritidis плазмидного типа 38:1,4 MDa, тогда как наблюдение в монокультуре показало, что рост и размножение S. Enteritidis плазмидного типа 38:1,4 MDa, явно доминировало.
- В отличие от сальмонелл в монокультуре все испытуемые микроорганизмы: Enteritidis, Sh. flexneri и Y. pseudotuberculosis на протяжении всего срока наблюдения (48 ч) росли с примерно одинаковой скоростью, тогда как при сокультивировании рост Y. pseudotuberculosis был подавлен в течение первого часа наблюдения, а наибольшую конкурентоспособность продемонстрировала S. Enteritidis.
- В периодической культуре можно изучать процессы взаимодействия как между различными видами микроорганизмов, так и их внутривидовые взаимоотношения. Экспериментальное изучение взаимодействия микробных популяций путем наблюдения за их развитием в периодической культуре при создании микроэкосистем – необходимый этап для понимания деятельности микроорганизмов в их естественной среде обитания.
Конфликт интересов: авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Финансирование исследования: авторы заявляют о финансировании проведенного исследования из собственных средств.
Участие авторов:
Концепция и дизайн исследования – ЯАА, РАВ
Сбор и обработка материала – РАВ, ПЮН
Статистическая обработка – РАВ
Написание текста – ЯАА, РАВ Редактирование – ЯАА, ЩМЮ
Список литературы
1. Бухарин О.В., Лобакова Е.С., Немцева Н.В., Черкасов С.В. Ассоциативный симбиоз. – Екатеринбург: УрО РАН; 2007; 264 с.
2. Яковлев А.А. Концепция интеграционно-конкурентного развития эпидемическго процесса. Тихоокеанский медицинский журнал 2006;3(25):10–4
3. Яковлев А.А., Раков А.В., Поздееева Е.С. Значение межвидовых и внутривидовых взаимодействий микроорганизмов как субоорганизменного уровня в иерархии эпидемического процесса. Эпидемиология и инфекционные болезни 2020;25(3):118–28.
4. Яковлев А.А., Поздеева Е.С. О возможных механизмах саморегуляции паразитарных систем в биогеоценозе. Вестник РАМН. 2018;73(3):184–94
5. Миллер Г.Г. Биологическое значение ассоциаций микроорганизмов. Вестник Российской академии медицинских наук. 2000:1;45–51.
6. Comolli LR. Intra- and inter-species interactions in microbial communities. Front. Microbiol. 2014;5:629. doi: 10.3389/fmicb.2014.00629
7. Barton ES, White DW, Cathelyn JS, et al. Herpesvirus latency confers symbiotic protection from bacterial infection. Nature 2007;447(7142):326–9. doi: 10.1038/nature05762
8. Ларин Ф.И., Жукова Л.И., Лебедев В.В., Рафеенко Г.К. Интерфирирующее взаимодействие вирусов в регуляции эпидемического процесса. Эпидемиология и инфекционные болезни. 2012;1:25–9.
9. Печуркин Н.С. Популяционная микробиология. Новосибирск, 1978. 277 с.
10. Тимченко Н.Ф., Раков А.В., Терентьева Н.А., Псарева Е.К., Яковлев А.А. Характеристика смешанных биопленок бактерий семейства Enterobacteriaceae Yersinia pseudotuberculosis и Salmonella Enteritidis in vitro. Здоровье. Медицинская экология. Наука. 2019;1(77):19–22.
11. Шкарин В.В., Саперкин Н.В. Взаимодействие возбудителей, сочетанных инфкций при комплексной коморбидности (теоретические и практические вопросы). Инфекционные болезни. 2021;5(11):737–43 doi: 10.32364/2587-6821-2021-5-11-737-743
12. Kado CL, Liu ST. Rapid procedure for detection and isolation of large and small plasmids. J.Bacteriology 1981;145(3):1365–73.
13. Белов А.Б., Огарков П.И. Эколого-эпидемиологическая систематика инфекционных болезней. Эпидемиология и инфекционные болезни. 2009;(6):49–54.
14. Калина Г.П., Трухина Г.М., Гришин Т.Д. Многомерность ниш в законе Гаузе применительно к прокариотам и метод пространственного разделения конкурирующих ассоциаций. Журнал микробиологии, эпидемиологии и иммунобиологии. 1989;10:10–7.
Об авторах
А. А. ЯковлевРоссия
Яковлев Анатолий Александрович – д-р мед. наук, ведущий научный сотрудник лаборатории кишечных инфекций; профессор кафедры эпидемиологии
тел. +7 (908) 970-93-37
А. В. Раков
Россия
Москва
Ю. Н. Показеева
Россия
Владивосток
М. Ю. Щелканов
Россия
Владивосток
Рецензия
Для цитирования:
Яковлев А.А., Раков А.В., Показеева Ю.Н., Щелканов М.Ю. Моделирование процессов меж- и внутривидового взаимодействия микроорганизмов в эксперименте на периодической культуре. Тихоокеанский медицинский журнал. 2023;(3):9-14. https://doi.org/10.34215/1609-1175-2023-3-9-14
For citation:
Yakovlev A.A., Rakov A.V., Pokazeeva Yu.N., Shchelkanov M.Yu. Modeling inter- and intraspecific interaction of microorganisms in a batch culture experiment. Pacific Medical Journal. 2023;(3):9-14. (In Russ.) https://doi.org/10.34215/1609-1175-2023-3-9-14





































