Перейти к:
Возможности оценки васкулогенной мимикрии на доклиническом этапе исследований соединений с предполагаемым противоопухолевым действием
https://doi.org/10.34215/1609-1175-2023-3-27-31
Аннотация
Активность диссеминации злокачественных новообразований во многом определяет прогноз при лечении пациентов с опухолями различных локализаций. Рост опухолей зависит от интенсивности образования кровеносных и альтернативных сосудов. Васкулогенная мимикрия (ВМ) отличается от традиционного неоангиоваскулогенетического процесса с участием эндотелия сосудов, является альтернативным типом кровоснабжения и относится к образованию сосудов, выстланных опухолевыми клетками. В настоящее время доступно несколько методов для выявления ВМ in vivo, но «золотым стандартом» по-прежнему остается иммуногистохимическое окрашивание специфических антигенов. Выделены основные критерии диагностирования структуры ВМ. Успешное лечение злокачественных заболеваний требует особого внимания на этапе доклинического изучения новых соединений с предполагаемым противоопухолевым действием на процесс ВМ. Хотя конкретный механизм, лежащий в основе индукции ВМ, еще не полностью выяснен, стратегия изучения данного процесса на этапе доклинической разработки позволит создать новые отечественные противоопухолевые и антиметастатические лекарственные средства с мультифакторным механизмом действия.
Ключевые слова
Для цитирования:
Масляникова А.А., Старостин С.И., Ермоленко М.Д., Трепель В.В., Гулян М.В., Додохова М.А., Котиева И.М. Возможности оценки васкулогенной мимикрии на доклиническом этапе исследований соединений с предполагаемым противоопухолевым действием. Тихоокеанский медицинский журнал. 2023;(3):27-31. https://doi.org/10.34215/1609-1175-2023-3-27-31
For citation:
Maslyanikova A.A., Starostin S.I., Ermolenko M.D., Trepel V.V., Gulyan M.V., Dodokhova M.A., Kotieva I.M. Possibilities for assessing vasculogenic mimicry during the preclinical study of antitumor compounds. Pacific Medical Journal. 2023;(3):27-31. (In Russ.) https://doi.org/10.34215/1609-1175-2023-3-27-31
Злокачественные новообразования являются социально значимой проблемой в России и в мире в целом. Одним из основных показателей, определяющих прогноз онкологического заболевания, является степень распространенности опухолевого процесса на момент его выявления. К сожалению, данный показатель остается стабильно высоким [1]. В связи с этим актуальной задачей междисциплинарных исследований является уточнение фундаментальных патогенетических механизмов процесса метастазирования, выяснения факторов, способствующих и ингибирующих рост вторичных опухолевых очагов в отдаленных органах и тканях.
Активность диссеминации злокачественных новообразований во многом определяет прогноз при лечении у пациентов с опухолями различных локализаций. Распространение атипичных клеток из первичного очага и последующий рост новых опухолевых колоний в тканях – это многоступенчатый процесс, известный как метастатический каскад. Эта последовательность событий включает в себя локальную инвазию первичных опухолевых клеток в окружающие ткани; интравазацию этих клеток и их внедрение в систему кровообращения (важно также выживание клеток при гематогенном транзите); остановку и экстравазацию через стенки сосудов в паренхиму отдаленных тканей; образование микрометастатических колоний в этой паренхиме; последующий рост микроскопических колоний до размеров выявляемых клинически метастатических очагов с активацией неоваскулогенеза в опухолевой ткани [2].
Опухолевой ангиогенез является ключевым фактором, связанным с ростом, прогрессированием и метастазированием опухоли [3]. Рост опухолей зависит от интенсивности роста кровеносных и альтернативных сосудов для снабжения кислородом и питательными веществами [4]. Ангиогенез в широком понимании – процесс формирования новых сосудов из существующих – обеспечивает расширение и ремоделирование сосудистой сети [5].
Цель: обсудить механизм васкулогенной мимикрии и предоставить рекомендации для изучения процесса на доклиническом этапе исследования соединений с предполагаемым противоопухолевым действием.
Васкулогенная мимикрия (ВМ) – это процесс, обнаруживаемый во многих злокачественных опухолях, отличающийся от традиционного неоангиоваскулогенетического прогрессирования с участием эндотелия сосудов. Данный феномен проявляется как альтернативный тип кровоснабжения, независимый от эндотелиальных сосудов и обусловленный образованием новых сосудов, выстланных опухолевыми клетками [6]. ВМ напрямую связана с инвазией опухоли и ее метастазированием [7][8][9] и обнаруживается при высокоинвазивных, агрессивно метастатических и запущенных злокачественных опухолях [10].
Формирование ВМ включает в себя самодеформацию высокозлокачественных опухолевых клеток, ремоделирование внеклеточного матрикса и, как следствие, образование сосудоподобной структуры, которая связана с существующими кровеносными сосудами [11].
Выделяют 2 типа ВМ (рис.): трубчатый и тип матрицы с рисунком [12][13].
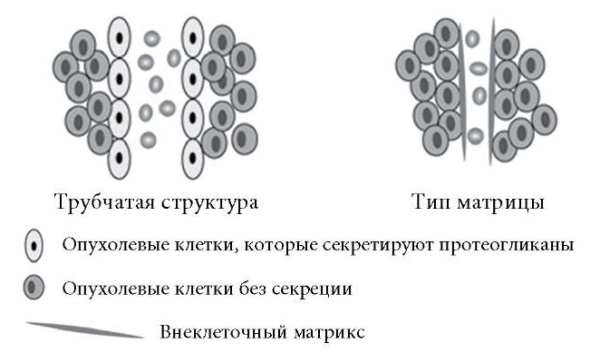
Рис. Схема формирования феномена васкулогенной мимикрии по Luo Q. и соавт. (2020).
Трубчатая структура состоит из опухолевых клеток и покрыта секретируемыми гликопротеинами. Описан ряд механизмов формирования структур подобного типа, таких как формирование путей через опухолевую ткань и инвазия стенок сосудов опухолевыми клетками [14].
Тип матрицы с рисунком имеет протоки, которые состоят из внеклеточного матрикса вместо клеток и представляет собой круговую сеть, образованную стромальным слоем, окружающим скопление опухолевых клеток. Эти слои расположены неравномерно, и в результате транспорт жидкости вокруг скоплений клеток неравномерен. Такая структура обеспечивает большую площадь диффузионной поверхности, чем трубчатая, облегчая доставку питательных веществ и кислорода к опухолевым клеткам [11]. Тип матрикса с рисунком включает опухолевые клетки и ткани, которые обернуты вокруг PAS(ШИК)-положительных матриксных белков, таких как ламинин, протеогликан гепарансульфата и коллагены IV и VI [15].
Выделяют также смешанный тип структур. При переходе от эндотелийзависимых сосудов к имитированным сосудам мозаичные сосуды встречаются как переходный тип между эндотелийзависимыми сосудами и каналами ВМ, при этом в васкуляризации опухоли участвуют как эндотелий хозяина, так и опухолевые клетки [16].
В настоящее время доступно несколько методов для выявления ВМ in vivo, но «золотым стандартом» по-прежнему остается иммуногистохимическое окрашивание специфических антигенов [17][18].
Структуры ВМ описываются как высокоперфузионные, богатые матриксом трубчатые или матриксные структуры, содержащие коллаген, протеогликаны гепарансульфата и плазму. В отличие от традиционного ангиогенеза, ВМ характеризуется плотным отложением опухолевых клеток и внеклеточного матрикса. Гликопротеины, образующие эти структуры, включают коллаген I, IV и VI типов, а также ламинин Ln5 и продукты его расщепления [19]. Сосудистые каналы в ВМ имеют несколько общих характеристик с эндотелийзависимой сосудистой сетью; однако их отличительные особенности выражены существенно. Например, эндотелиальные клетки экспрессируют сосудистый эндотелиальный (VE)-кадгерин, также известный как CD144, основную молекулу, связанную с межклеточной адгезией в эндотелиальных адгезивных соединениях. Однако в атипичных клетках, способных образовывать ВM, VE-кадгерин экспрессируется аберрантно и, по-видимому, участвует в другой функции, а именно в приобретении трубкообразных структур [20].
Уникальное расположение сеток ВМ имитирует эмбриональный васкулогенез. Предполагается, что злокачественные опухолевые клетки в процессе развития приобретают эмбриональный фенотип. Анализ экспрессии генов показал, что агрессивные опухолевые клетки, способные к ВМ, демонстрируют разнообразный профиль генов, экспрессируя гены из нескольких типов клеток, таких как эпителиальные клетки, фибробласты и эндотелиальные клетки [21].
Кадгерин эндотелия сосудов (VE-кадгерин), также известный как кадгерин 5 или CD144, представляет собой белок межклеточной адгезии, обычно экспрессируемый эндотелиальными клетками. Фосфорилирование VE-кадгерина по ряду аминокислотных остатков может модулировать стабильность и проницаемость эндотелиального соединения в различных контекстах [22].
Фактически, VE-кадгерин был обнаружен в высокоагрессивных опухолевых клетках, но он не экспрессировался их малоагрессивными аналогами. Более того, понижающая регуляция VE-кадгерина приводит к ингибированию образования ВМ [23].
Опухолевые клетки, участвующие в ВМ, напоминают мезенхимальные клетки, полученные в результате перехода от эпителия к мезенхиме, который характеризуется понижающей регуляцией эпителиальных маркеров (например, цитокератина), потерей клеточной полярности (Е-кадгерин, окклюдин) и усилением регуляции мезенхимальных маркеров (виментин, N-кадгерин, фибронектин) [15]. Кроме того, эти клетки ВМ имеют эндотелиальный фенотип [14][20][24].
ВМ может представлять собой важный механизм выживания опухоли и способствовать неэффективности современной антиангиогенной терапии, направленной на полное лишение опухолей кровоснабжения [25]. ВМ часто наблюдается в областях между опухолью и окружающими нормальными тканями [26].
Выделены основные критерии диагностирования структуры ВМ [27]:
- отсутствие эндотелиальных клеток сосудов на внутренней стенке кровеносного сосуда ВМ;
- сосудоподобные каналы выстланы опухолевыми клетками;
- положительный результат при окрашивании PAS
(ШИК), но отрицательный при окрашивании CD31/ CD34, в то время как эндотелиальные сосудистые каналы отрицательный для окрашивания PAS (ШИК), но положительный для окрашивания CD31/ CD34; 4) эритроциты в сосудистых каналах.
Краткая характеристика маркеров для гистологического и иммуногистохимического анализа ВМ представлена в таблице.
Таблица
Перечень маркеров для диагностики васкулогенной мимикрии
Маркер васкулогенной мимикрии | Описание маркера |
PAS-реакция (ШИК-реакция)позитивная реакция | Обнаружение полисахаридов, гликозаминогликанов, мукопротеинов, гликопротеинов, гликолипидов и фосфолипидов, на практике чаще используется для определения гликозаминогликанов |
Anti-VE Cadherin antibodyпозитивная реакция | Белок клеточной адгезии эндотелия сосудов из семейства кадгеринов, играет важную роль в клеточной биологии эндотелия, т. к. контролирует и организует межклеточные соединения |
Anti-CD31 antibody-негативная реакция | Важную роль в процессах неоваскуляризации играют ангиогенные Т-лимфоциты (CD31). Они локализуются между эндотелиальными клетками кровеносных сосудов, обеспечивают клеточную адгезию и регулируют эндотелиальную проницаемость. CD31 характеризуют активность процессов ангиогенеза [26] |
Anti-CD34 antibody-негативная реакция | Маркер ранней дифференцировки клеток-предшественников гемопоэза и эндотелиальных клеток – трансмембранный белок CD34. Данный белок определяет сосудистую плотность, а его уровень коррелирует с процессами васкулогенеза [28] |
Авторы двойного окрашивания (PAS+CD31/34–) эндотелиального маркера CD34 для идентификации эндотелия в срезах ткани и окрашивания PAS для определения базальной мембраны кровеносных сосудов опухоли сравнили специфичность и интенсивность визуализации CD34 и CD31 для определения эндотелия при астроцитоме и обнаружили, что CD34 приводит к более четкому мечению и более легкому определению эндотелия, чем CD31 [29][30].
В настоящее время не существует безошибочного биомаркера для идентификации каналов ВM, но были описаны некоторые специфические характеристики и экспрессия конкретных маркеров, связанных с этими клеточными структурами [31].
По нашему мнению, наличие CD31/CD34негативных и PAS-позитивных клеток, а также эритроцитов в сосуде может быть использовано в качестве критериев идентификации ВМ в процессе доклинического изучения соединений с предполагаемым противоопухолевым действием.
Сначала проводят окрашивание CD31/CD34 с использованием моноклонального антитела для идентификации эндотелиальных клеток, а затем инкубируют с периодической кислотой Шиффа (PAS) для маркировки базальной мембраны трубчатых структур [32]. Для иммуногистохимического окрашивания CD31 эндотелийзависимые сосуды (EVs) оцениваются путем подсчета CD31-позитивных сосудов в 10 случайно выбранных полях [33]. Каналы, образованные опухолевыми клетками при ВМ, могут не окрашиваться различными иммуногистохимическими маркерами эндотелиальных клеток совсем или окрашиваться прерывистым образом [34]. Изучение данных диагностических критериев ВМ в эксперименте позволит разработать новые стратегии снижения вторичной диссеминации опухолевых клеток.
Выводы
Для доклинической разработки новых субстанций с предполагаемым противоопухолевым действием необходимо оценивать влияние тестируемых соединений на активность классического и альтернативного неоангиогенеза. Хотя конкретный механизм, лежащий в основе индукции ВМ, еще не полностью выяснен, стратегия изучения данного процесса в эксперименте позволит разработать новые отечественные противоопухолевые и антиметастатические лекарственные средства с мультифакторным механизмом действия.
Конфликт интересов: авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Источник финансирования: авторы заявляют о финансировании проведенного исследования из собственных средств.
Участие авторов:
Концепция и дизайн исследования – ИМК
Сбор и обработка материала – ААМ, СИС, МДЕ, ВВТ
Написание текста – МВГ, МАД Редактирование – ИМК
Список литературы
1. Состояние онкологической помощи населению России в 2019 году. Под ред. А.Д. Карпина, В.В. Старинского, А.О. Шахзадовой, М.: МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2020. 239 с.
2. Fares J, Fares MY, Khachfe HH, Salhab HA, Fares Y. Molecular principles of metastasis: a hallmark of cancer revisited. Signal Transduction and Targeted Therapy 2020;5(1):28. doi: 10.1038/s41392-020-0134-x
3. Qi S, Deng S, Lian Z, Yu K. Novel Drugs with high efficacy against tumor angiogenesis. International Journal of Molecular Sciences. 2022;23(13):6934. doi: 10.3390/ijms23136934
4. Tang E., Lahmi L., Meillan N., Pietta G., Albert S., Maingon P. Treatment strategy for distant synchronous metastatic head and neck squamous cell carcinoma. Current Oncology Reports, 2019;21(11):102. doi: 10.1007/s11912-019-0856-5
5. Zhou J, Wang L, Peng C, Peng F. Co-targeting tumor angiogenesis and immunosuppressive tumor microenvironment. Frontiers Pharmacology. 2022;13:886198. doi: 10.3389/fphar.2022.886198
6. Zhang X., Zhang J., Zhou H., Fan G., Li Q. Molecular mechanisms and anticancer therapeutic strategies in vasculogenic mimicry. Journal of Cancer. 2019;10(25):6327–40. doi: 10.7150/jca.34171
7. Hendrix MJ, Seftor EA, Seftor RE, Chao JT, Chien DS, Chu YW. Tumor cell vascular mimicry: novel targeting opportunity in melanoma. Pharmacology & Therapeutics 2016;159:83–92. doi: 10.1016/j.pharmthera.2016.01.006
8. Simizu S. Vasculogenic mimicry: A dynamic event of malignancy. Biochimica et Biophysica Acta. 2022;1866(3):130084. doi: 10.1016/j.bbagen.2022.130084
9. Chavoshi H, Poormolaie N, Vahedian V, Kazemzadeh H, Mir A, Nejabati HR, Behroozi J, Isazadeh A, Hajezimian S, Nouri M, Maroufi NF. Vascular mimicry: A potential therapeutic target in breast cancer. Pathology Research and Practice, 2022; 234:153922. doi: 10.1016/j.prp.2022.153922
10. Wei X, Chen Y, Jiang X, Peng M, Liu Y, Mo Y, Ren D, Hua Y, Yu B, Zhou Y, Liao Q, Wang H, Xiang B, Zhou M, Li X, Li G, Li Y, Xiong W, Zeng Z. Mechanisms of vasculogenic mimicry in hypoxic tumor microenvironments. Molecular Cancer, 2021, 4;20(1):7. doi: 10.1186/s12943-020-01288-1
11. Luo Q, Wang J, Zhao W, Peng Z, Liu X, Li B, Zhang H, Shan B, Zhang C, Duan C. Vasculogenic mimicry in carcinogenesis and clinical applications. Journal of Hematology and Oncology. 2020, 14;13(1):19. doi: 10.1186/s13045-020-00858-6
12. Lee AW, Ma BB, Ng WT, Chan AT. Management of Nasopharyngeal Carcinoma: Current Practice and Future Perspective. Journal of Clinical Oncology, 2015;33(29):3356–64. doi: 10.1200/JCO.2015.60.9347
13. Luo Q, Wang J, Zhao W, Peng Z, Liu X, Li B, Zhang H, Shan B, Zhang C, Duan C. Vasculogenic mimicry in carcinogenesis and clinical applications. J Hematol Oncol. 2020;13(1):19. doi: 10.1186/s13045-020-00858-6
14. Folberg R, Maniotis AJ. Vasculogenic mimicry. APMIS. 2004; 112(7–8):508–25. doi: 10.1111/j.1600-0463.2004.apm11207-0810.x
15. Ayala-Dominguez L, Olmedo-Nieva L, Munoz-Bello JO, Contreras-Paredes A, Manzo-Merino J, Martinez-Ramirez I. Mechanisms of vasculogenic mimicry in ovarian cancer. Frontiers in Oncology. 2019;9:998. doi: 10.3389/fonc.2019.00998
16. Liu J, Huang J, Yao WY, Ben QW, Chen D.F, He XY, Li L, Yuan YZ. The origins of vacularization in tumors. Frontiers in Bioscience-Landmark. 2012;17(7):2559–65. doi: 10.2741/4071
17. Biagioni A, Andreucci E. Immunohistochemistry for VM Markers. Methods in Molecular Biology. 2022;2514:141–52. doi: 10.1007/978-1-0716-2403-6_14
18. Folberg R, Hendrix MJ, Maniotis AJ. Vasculogenic mimicry and tumor angiogenesis. American Journal of Pathology. 2000;156(2):361–81. doi: 10.1016/S0002-9440(10)64739-6
19. Hao XS, Sun BC, Zhang SW, Zhao XL. Correlation between the expression of collgen IV, VEGF and vasculogenic mimicry. Zhonghua Zhong Liu Za Zhi, 2003;25(6):524–6.
20. Delgado-Bellido D, Serrano-Saenz S, Fernández-Cortés M, Oliver FJ. Vasculogenic mimicry signaling revisited: focus on non-vascular VE-cadherin. Molecular Cancer. 2017;16(1):65. doi: 10.1186/s12943-017-0631-x
21. Seftor EA, Meltzer PS, Kirschmann DA, Pe’er J, Maniotis AJ, Trent JM, Folberg R, Hendrix MJ. Molecular determinants of human uveal melanoma invasion and metastasis. Clinical and Experimental Metastasis. 2002;19(3):233–46. doi: 10.1023/a:1015591624171
22. Breier G, Grosser M, Rezaei M. Endothelial cadherins in cancer. Cell and Tissue Research. 2014;355(3):523–7. doi: 10.1007/s00441-014-1851-7
23. Hendrix MJ, Seftor EA, Meltzer PS, Gardner LM, Hess AR, Kirschmann DA, Schatteman GC, Seftor RE. Expression and functional significance of VE-cadherin in aggressive human melanoma cells: role in vasculogenic mimicry. Proceedings of the National Academy of Sciences. 2001;98(14):8018–23. doi: 10.1073/pnas.131209798
24. Cai H, Liu W, Liu X, Li Z, Feng T, Xue Y, Liu Y. Advances and Prospects of Vasculogenic Mimicry in Glioma: A Potential New Therapeutic Target? OncoTargets and Therapy 2020;13:4473–83. doi: 10.2147/OTT.S247855
25. Ge H, Luo H. Overview of advances in vasculogenic mimicry – a potential target for tumor therapy. Cancer Management and Research 2018;10:2429–37. doi: 10.2147/CMAR.S164675
26. Ruzinova MB, Benezra R. Id proteins in development, cell cycle and cancer. Trends in Cell Biology 2003;13(8):410–8. doi: 10.1016/s0962-8924(03)00147-8
27. Xiang T, Lin YX, Ma W, Zhang HJ, Chen KM, He GP, Zhang X, Xu M, Feng QS, Chen MY, Zeng MS, Zeng YX, Feng L. Vasculogenic mimicry formation in EBV-associated epithelial malignancies. Nature Communications. 2018;9(1):5009. doi: 10.1038/s41467-018-07308-5
28. Доброхотова Ю.Э, Боровкова Е.И, Арутюнян А.М., Данелян С.Ж, Малышева Е.М., Жарков Н.В, Аксенова Т.Н. Особенности васкулогенеза и ангиогенеза в плаценте на фоне химиотерапии. Русский медицинский журнал. Мать и дитя. 2021;4(1):23–30. doi: 10.32364/2618-8430-2021-4-1-23-30.
29. Yue WY, Chen ZP. Does vasculogenic mimicry exist in astrocytoma? Journal of Histochemistry and Cytochemistry. 2005; 53(8):997–1002. doi: 10.1369/jhc.4A6521.2005
30. Ротин Д.Л, Титов К.С., Казаков А.М. Васкулогенная мимикрия при меланоме: молекулярные механизмы и клиническое значение. Российский биотерапевтический журнал. 2019;18(1):16–24.
31. García-Quiroz J, García-Becerra R, Santos-Cuevas C, Ramírez-Nava GJ, Morales-Guadarrama G, Cárdenas-Ochoa N, Segovia-Mendoza M, Prado-Garcia H, Ordaz-Rosado D, Avila E, Olmos-Ortiz A, López-Cisneros S, Larrea F, Díaz L. Synergistic antitumorigenic activity of calcitriol with curcumin or resveratrol is mediated by angiogenesis inhibition in triple negative breast cancer xenografts. Cancers (Basel). 2019;11(11):1739. doi: 10.3390/cancers11111739
32. Chen YS, Chen ZP. Vasculogenic mimicry: a novel target for glioma therapy. Chinese Journal of Cancer. 2014;33(2):74–9. doi: 10.5732/cjc.012.10292
33. Wang H, Lin H, Pan J, Mo C, Zhang F, Huang B, Wang Z, Chen X, Zhuang J, Wang D, Qiu S. Vasculogenic mimicry in prostate cancer: the roles of EphA2 and PI3K. Journal of Cancer, 2016;7(9):1114–24. doi: 10.7150/jca.14120
34. Andonegui-Elguera MA, Alfaro-Mora Y, Cáceres-Gutiérrez R, Caro-Sánchez CS, Herrera LA, Díaz-Chávez J. An overview of vasculogenic mimicry in breast cancer. Frontiers in Oncology. 2020;10:220. doi: 10.3389/fonc.2020.00220
Об авторах
А. А. МасляниковаРоссия
Ростов-на-Дону
С. И. Старостин
Россия
Ростов-на-Дону
М. Д. Ермоленко
Россия
Ростов-на-Дону
В. В. Трепель
Россия
М. В. Гулян
Россия
Ростов-на-Дону
М. А. Додохова
Россия
Додохова Маргарита Авдеевна – к.м.н., доцент кафедры патологической физиологии ФГБОУ ВО «Ростовский
государственный медицинский университет»
Минздрава России (344022, Ростов-на-Дону, пер. Нахичеванский, 29
тел. (928) 185-09-01
И. М. Котиева
Россия
Ростов-на-Дону
Рецензия
Для цитирования:
Масляникова А.А., Старостин С.И., Ермоленко М.Д., Трепель В.В., Гулян М.В., Додохова М.А., Котиева И.М. Возможности оценки васкулогенной мимикрии на доклиническом этапе исследований соединений с предполагаемым противоопухолевым действием. Тихоокеанский медицинский журнал. 2023;(3):27-31. https://doi.org/10.34215/1609-1175-2023-3-27-31
For citation:
Maslyanikova A.A., Starostin S.I., Ermolenko M.D., Trepel V.V., Gulyan M.V., Dodokhova M.A., Kotieva I.M. Possibilities for assessing vasculogenic mimicry during the preclinical study of antitumor compounds. Pacific Medical Journal. 2023;(3):27-31. (In Russ.) https://doi.org/10.34215/1609-1175-2023-3-27-31





































