Перейти к:
Спектр вторичного излучения маркера предлучевой разметки волластонита/гидроксиапатита
https://doi.org/10.34215/1609-1175-2024-4-48-52
Аннотация
Цель: определить возможность генерации вторичного излучения на графте волластонита/гидроксиапатита (волластонит/ГАП), который имеет потенциал использования в качестве маркера для послеоперационной предлучевой разметки.
Материалы и методы: во время имитации сеанса лучевой терапии был изучен спектр вторичного излучения, генерируемый на графте волластонит/ГАП и полиакриламиде. Полиакриламид по составу основных химических элементов близок к мягким тканям человека, что позволяет его использовать в качестве эквивалента. Волластонит/ГАП был получен методом плазменно-реактивного спекания порошка Ca3(Si3O9) в смеси с реакционноспособными компонентами (CaO и CaHPO4ГАП). Имитация лучевой терапии проводилась на медицинском линейном ускорителе «TRUEBEAM» производства Varian Medical Systems при энергии фотонов 6 мегаэлектрон-вольт (МэВ) с созданием экрана из переносных свинцовых блоков и формированием отверстия в них диаметром 10 мм, через которое происходило облучение. Для регистрации распределения фотонов использовался гамма-спектрометр СКС-50М с детектором на основе сверхчистого германия. Показания приборов суммировались с шагом в 50 килоэлектронвольт (кэВ) в диапазоне от 0 до 2650 кэВ и были представлены в виде графика. В каждом диапазоне проводилось три измерения, после чего вычислялась средняя арифметическая и ошибка средней арифметической. Достоверность различия средних величин определялась по критерию Стьюдента.
Результаты: вторичное излучение на исследуемых образцах в диапазоне 51–100 кэВ составило незначительное различие: волластанит/ГАП 23,18 ± 2,57 импульса/секунду против полиакриламида 21,57 ± 2,37 импульса/секунду с нивелировкой в энергиях 101–150 кэВ – волластанит/ГАП 21,18 ± 2,51 импульса/секунду против полиакриламида 22,9 ± 2,41 импульса/секунду. Однако эти различия не были статистически значимыми.
Заключение: графт микрочастиц волластанит/ГАП является перспективным материалом для точной послеоперационной/предлучевой разметки при планировании лучевой терапии и не требует перерасчета дозы излучения.
Ключевые слова
Для цитирования:
Пасечник А.А., Апанасевич В.И., Папынов Е.К., Шичалин О.О., Аргишев О.А., Стегний К.В., Невожай В.И., Костив Е.П., Темченко В.В., Борисенко А.В., Панкратов И.В. Спектр вторичного излучения маркера предлучевой разметки волластонита/гидроксиапатита. Тихоокеанский медицинский журнал. 2024;(4):48-52. https://doi.org/10.34215/1609-1175-2024-4-48-52
For citation:
Pasechnik A.A., Apanasevich V.I., Papynov E.K., Shichalin O.O., Argishev O.A., Stegniy K.V., Nevozhay V.I., Kostiv E.P., Temchenko V.V., Borisenko A.V., Pankratov I.V. Spectrum of secondary radiation from the hydroxyapatite-wollastonite marker for pre-irradiation marking. Pacific Medical Journal. 2024;(4):48-52. (In Russ.) https://doi.org/10.34215/1609-1175-2024-4-48-52
В настоящее время методики лечения рака молочной железы (РМЖ) позволяют провести органосохраняющие операции, максимально снижая риск психотравмы для пациентов. Но остается проблема сохранения жизнеспособных опухолевых клеток в границах послеоперационной раны даже при негативных краях [1]. Для полной эрадикации опухолевых клеток используется адъювантная лучевая терапия с дополнительным облучением ложа опухоли (буст). Учитывая то обстоятельство, что большинство местных рецидивов РМЖ происходят проксимальнее исходного места первичного рака, доставка дополнительной дозы ионизирующего излучения на оставшуюся ткань молочной железы является стандартом лечения в течение нескольких десятилетий [2].
Хотя положительный эффект послеоперационной лучевой терапии РМЖ хорошо документирован, это лечение может быть связано с рядом осложнений, которые могут повлиять как на качество жизни пациентов, так и на выживаемость. Общепринятой методикой обозначения краев операционной раны является маркировка с помощью имплантируемых рентгеноконтрастных скрепок [3-5]. Однако расположение 3, 4 или даже 5 скрепок не может в точности передать всю сложность топографии послеоперационной раны, которая претерпевает значительные пространственные деформации, особенно в случаях, когда имеется сочетание с онкопластической операцией [6-8]. Чтобы избежать или уменьшить число осложнений лучевой терапии РМЖ и для более точного определения локализации нами предложена интраоперационная методика маркировки краев ложа опухоли биодеградируемым, рентгеноконтрастным материалом волластонит/ГАП. Так как ранее использование этого маркера для подобных задач не проводилось, а при реализации программы лечения РМЖ предполагается послеоперационная лучевая терапия, то в случае генерации вторичного излучения в спектрах, отличных от генерации на мягких тканях человека, актуален вопрос об учете этого фактора при составлении планов лучевой терапии.
Цель исследования – определить возможность генерации вторичного излучения на графте волластонит/ГАП, который имеет потенциал использования в качестве маркера для послеоперационной предлучевой разметки ложа опухоли молочной железы.
Материалы и методы
Объект исследования. Был изучен спектр вторичного излучения в рентгеновском диапазоне, генерируемый на полиакриламиде и графте волластанит/ГАП (размер частиц от 200 до 1000 мкм). Полиакриламид по составу основных химических элементов близок к мягким тканям человека, что позволяет его использовать в качестве эквивалента. Графт волластонита с гидроксиапатитом, предполагаемый для введения в полость операционной раны для маркировки краев, был получен с применением метода искрового плазменно-реактивного спекания (ИП-РС). Метод основан на электроимпульсном спекании порошка Ca3(Si3O9) в смеси с реакционноспособными компонентами (CaO и CaHPO4ГАП). Спекание проводили на установке SPS-515S фирмы «Dr.Sinter*LAB™» (Япония) при температуре 1000 °C и скорости нагрева 100 °С/мин, времени выдержки 5 мин, приложенном давлении 22,3 мегапаскаля (МПа). В качестве исходных реагентов использовали коммерческие порошки CaHPO4 и CaO (Sigma-Aldrich, чистота 99,98%) с размером частиц 5 и 7 мкм [9][10].
Облучение проводилось на медицинском линейном ускорителе «TRUEBEAM» производства Varian Medical SystemsСША при энергии фотонов 6 МэВ с созданием экрана из переносных свинцовых блоков с формированием отверстия в блоке диаметром 10 мм, через которое проводилось облучение образцов. Для регистрации распределения фотонов использовался гамма-спектрометр СКС-50М с детектором на основе сверхчистого германия производства фирмы ORTEC (Model: GEM15P4, Serial No45-TP21994A США) (рис. 1).
В качестве контроля использовался полиакриламид в виде пластинки толщиной 1,0 см производства SNF Group (Франция).
Показания приборов суммировались с шагом в 50 кэВ в диапазоне от 0 до 2650 кэВ и были представлены в виде графика. В каждом диапазоне проводилось три измерения, после чего вычислялась средняя арифметическая и ошибка средней арифметической. Достоверность различия средних величин определялась по критерию Стьюдента.
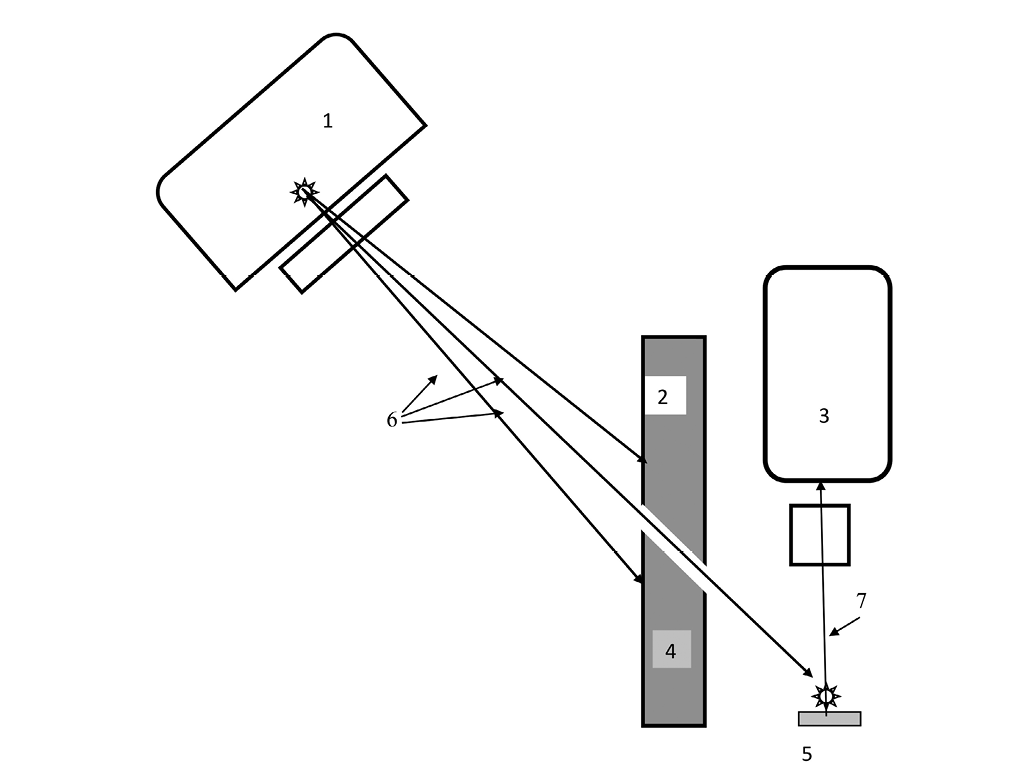
Рис. 1. Схема расположения оборудования в эксперименте.
1. Источник излучения – линейный ускоритель TRUE-BEAM. 2. Свинцовый экран, толщина – 5 см. 3. Гамма-спектрометр СКС-50М с детектором на основе сверхчистого германия производства фирмы ORTEC (Model: GEM15P4, Serial No45-TP21994A, США). 4. Отверстие в свинцовом экране. 5. Исследуемый образец. 6. Излучение. 7. Вторичное излучение.
Результаты исследования
Как видно из графиков, представленных на рис. 2, кривая как для полиакриламида, так и для графта волластанит/ГАП имеет три четко выраженных пика. Первый пик с энергией фотонов от 50 до 150 кэВ – это вторичное излучение в рентгеновском диапазоне, которое генерируется непосредственно на исследуемых образцах. Число фотонов составило 2,58 ± 0,3 для графта волластанит/ГАП и 2,57 ± 0,03 импульса/сек для полиакриламида. Различие между показателями несущественно. В энергиях фотонов в диапазоне 51–100 кэВ имеется некоторое статистически незначимое различие: волластанит/ГАП 23,18 ± 2,57 импульса/секунду против полиакриламида 21,57 ± 2,37 импульса/секунду с нивелировкой в энергиях 101–150 кэВ – волластанит/ГАП 21,18 ± 2,51 импульса/секунду против полиакриламида 22,9 ± 2,41 импульса/секунду. Генерация фотонов с энергией в диапазоне от 0 до 150 кэВ осуществляется в основном за счет фотоэффекта [11].
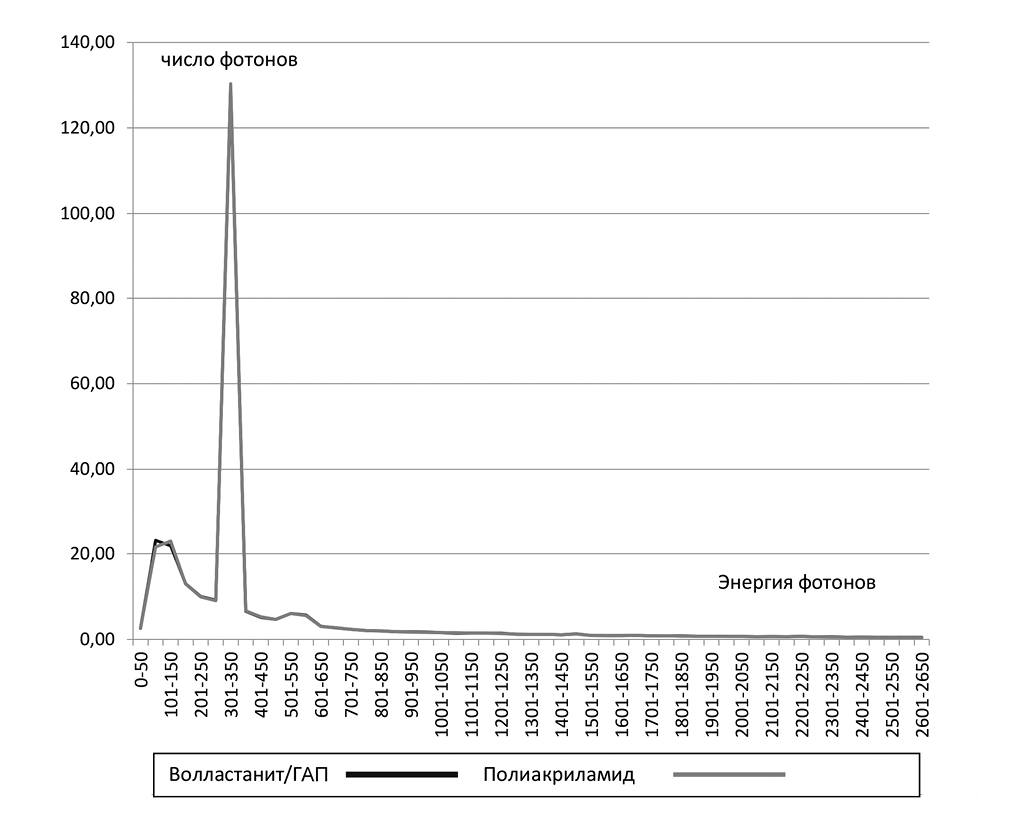
Рис. 2. Спектр вторичного излучения, полученный при воздействии излучения 6 МэВ, на волластонит/ГАП и полиакриламид (объяснения в тексте).
Второй пик связан с вторичным излучением, генерируемом на свинцовой защите с энергией фотонов 301–350 кэВ и достигал 129,25 ± 16,76 импульса/секунду при измерении спектра на графте волластанит/ГАП и 130,35 ± 15,3 импульса/секунду на образце полиакриламида и осуществляется в основном за счет Комптон-эффекта [11]. Статистически значимого различия в этом диапазоне отмечено не было. О генерации фотонов пика 301–350 кэВ на свинцовой защите говорит его присутствие при снятии показаний спектрометра при отсутствии облучаемого образца.
Третий пик регистрируется в области энергий фотонов в диапазоне 501–559 кэВ. Это область (511 кэВ) рождения и аннигиляции электрон-позитронных пар. На образцах волластанит/ГАП он составил 6,06 ± 0,73, а на образце полиакриламида – 6,06 ± 0,7 импульса/секунду, различия статистически незначимы. В остальных диапазонах энергий показатели пиков не имели, как не имели и статистически значимых различий [11].
Обсуждение полученных результатов
Данные нашего исследования показывают, что вторичное излучение на исследуемых образцах в диапазоне 51–100 кэВ составило незначительное различие: волластанит/ГАП 23,18 ± 2,57 импульса/секунду против полиакриламида 21,57 ± 2,37 импульса/секунду с нивелировкой в энергиях 101–150 кэВ – волластанит/ГАП 21,18 ± 2,51 импульса/секунду против полиакриламида 22,9 ± 2,41 импульса/секунду. Однако эти различия не были статистически значимыми.
Отсутствие статистически значимого различия генерации вторичного излучения во всех диапазонах спектра от 150 до 2650 кэВ межу графтом волластанит/ГАП и биологическим эквивалентом мягких тканей человека – полиакриламидом [12] дает возможность использования графта волластанит/ГАП в качестве материала для маркировки ложа удаленного участка молочной железы с опухолью без перерасчета планов лучевой терапии. С другой стороны, графт волластанит/ГАП имеет мелкую дисперсность и рентгеноконтрастность, что позволяет после операции с высокой точностью проследить и корректно построить план послеоперационной лучевой терапии.
Выводы
Использование перспективного материала графта волластанит/ГАП для послеоперационной/предлучевой разметки не усложняет ход операции, не потребует дополнительных расчетов и корректировки плана лучевой терапии после хирургического лечения рака молочной железы.
Список литературы
1. Meattini I, Lambertini M, Desideri I, De Caluwé A, Kaidar-Person O, Livi L. Radiation therapy for young women with early breast cancer: Current state of the art. Crit Rev Oncol Hematol. 2019;137:143–153. doi: 10.1016/j.critrevonc.2019.02.014
2. Rutqvist LE, Rose C, Cavallin-Ståhl E. A systematic overview of radiation therapy effects in breast cancer. ActaOncol. 2003;42(5-6):532–45. doi: 10.1080/02841860310014444
3. La Rocca E, Lici V, Giandini T, Bonfantini F, Frasca S, Dispinzieri M, Gennaro M, S DC, Di Cosimo S, Lozza L, Pignoli E, Valdagni R, De Santis MC. Interobserver variability (between radiation oncologist and radiation therapist) in tumor bed contouring after breast-conserving surgery. Tumori. 2019;105(3):210–215. doi: 10.1177/0300891619839288
4. Furet E, Peurien D, Fournier-Bidoz N, Servois V, Reyal F, Fourquet A, Rouzier R, Kirova YM. Plastic surgery for breast conservation therapy: how to define the volume of the tumor bed for the boost? Eur J Surg Oncol. 2014;40(7):830–4. doi: 10.1016/j.ejso.2014.03.009
5. Hunter MA, McFall TA, Hehr KA. Breast-conserving surgery for primary breast cancer: necessity for surgical clips to define the tumor bed for radiation planning. Radiology. 1996;200:281–2.
6. Aldosary G, Caudrelier JM, Arnaout A, Chang L, Tse T, Foottit C, Song J, Belec J, Vandervoort E. Can we rely on surgical clips placed during oncoplastic breast surgery to accurately delineate the tumor bed for targeted breast radiotherapy? Breast Cancer Res Treat. 2021;186(2):343–352. doi: 10.1007/s10549-020-06086-3
7. Sharma R, Spierer M, Mutyala S, Thawani N, Cohen HW, Hong L, Garg MK, Kalnicki S. Change in seroma volume during whole-breast radiation therapy. Int J Radiat Oncol Biol Phys. 2009;75(1):89–93. doi: 10.1016/j.ijrobp.2008.10.037
8. Sung S, Lee JH, Lee JH, Kim SH, Kwak YK, Lee SW, Jeon YW, Suh YJ. Displacement of surgical clips during postoperative radiotherapy in breast cancer patients who received breast-conserving surgery. J Breast Cancer. 2016;19:417–22.
9. Papynov EK, Shichalin OO, Medkov MA, Grishchenko DN, Portnyagin AS, Merkulov EB, et al. ZrO<sub>2</sub>-phosphates porous ceramic obtained via sps-rs “in situ” technique: Bacteria test assessment. Ceram Int. 2019;45(11):13838–46.
10. Stevens MM. Biomaterials for bone tissue engineering. Mater Today. 2008;11(5):18–25.
11. Li Z, Michelet C, Incerti S, Ivanchenko V, Novak M, Guatelli S, Seznec H. Implementation of the EPICS2017 database for photons in Geant4. PhysMed. 2022;95:94–115. doi: 10.1016/j.ejmp.2022.01.008
12. Wielopolski L, Maryanski M, Washington AC, Schidlovsky G, Cohn SH, Reinstein LE, Kalend AM, Meek AB. Polyacrylamide-based phantoms as tissue substitute in experimental radiation physics. Med Phys. 1985;12(6):788–92. doi: 10.1118/1.595666
Об авторах
А. А. ПасечникРоссия
Андрей Александрович Пасечник, аспирант
Институт хирургии
690033; ул. Гамарника, 10, кв. 21; Владивосток
тел.: 8 (966) 293-95-52
В. И. Апанасевич
Россия
Владивосток
Е. К. Папынов
Россия
Владивосток
О. О. Шичалин
Россия
Владивосток
О. А. Аргишев
Россия
Владивосток
К. В. Стегний
Россия
Владивосток
В. И. Невожай
Россия
Владивосток
Е. П. Костив
Россия
Владивосток
В. В. Темченко
Россия
Владивосток
А. В. Борисенко
Россия
Владивосток
И. В. Панкратов
Россия
Владивосток
Рецензия
Для цитирования:
Пасечник А.А., Апанасевич В.И., Папынов Е.К., Шичалин О.О., Аргишев О.А., Стегний К.В., Невожай В.И., Костив Е.П., Темченко В.В., Борисенко А.В., Панкратов И.В. Спектр вторичного излучения маркера предлучевой разметки волластонита/гидроксиапатита. Тихоокеанский медицинский журнал. 2024;(4):48-52. https://doi.org/10.34215/1609-1175-2024-4-48-52
For citation:
Pasechnik A.A., Apanasevich V.I., Papynov E.K., Shichalin O.O., Argishev O.A., Stegniy K.V., Nevozhay V.I., Kostiv E.P., Temchenko V.V., Borisenko A.V., Pankratov I.V. Spectrum of secondary radiation from the hydroxyapatite-wollastonite marker for pre-irradiation marking. Pacific Medical Journal. 2024;(4):48-52. (In Russ.) https://doi.org/10.34215/1609-1175-2024-4-48-52





































