Перейти к:
Вальпроевая кислота и целекоксиб усиливают влияние темозоломида на клетки глиобластомы
https://doi.org/10.34215/1609-1175-2024-4-53-58
Аннотация
Цель: оценить выживаемость пациентов с рецидивирующей глиобластомой, получавших вальпроевую кислоту (VPA), и изучить ее влияние в комбинации с темозоломидом (ТМЗ) и целекоксибом (CXB) на опухолевые клетки.
Материалы и методы. Ретроспективно проанализированы данные пациентов с глиобластомой (МКБ10 – C71), получавших VPA в структуре комплексного лечения и реоперированных с рецидивом глиобластомы. Для экспериментального исследования использованы опухолевые клетки линий С6, U87 и Т98G. Моделирование глиобластомы выполнено с использованием крыс породы Вистар. Работа одобрена этическим комитетом.
Результаты. Медиана общей выживаемости пациентов с глиобластомой, принимающих VPA, составила 22 мес; пациентов, не получавших VPA, – 13 мес. В эксперименте in vitro концентрация полумаксимального ингибирования (IC50) ТМЗ для различных линий опухолевых клеток варьировала от 435,3 до 844 μM; IC50 VPA для опухолевых клеток линии U87MG, T98G и С6 составила 1510, 3900 и 3600 μM; IC50 CXB для этих линий опухолевых клеток составила 30,1, 41,07 и 48,4 μM соответственно. VPA достоверно усиливала антиглиомный эффект ТМЗ в отношении опухолевых клеток лини U87; наибольшей восприимчивостью к действию CXB c ТМЗ обладали опухолевые клетки линии С6 и T98G. Комбинация VPA с CXB усиливала антиглиомное действие ТМЗ in vitro и in vivo, что сопровождалось уменьшением объема опухоли (p < 0,05) и увеличением выживаемости экспериментальных животных.
Заключение: высокий антиглиомный потенциал комбинации VPA и CXB с ТМЗ открывает перспективы ее использования для оптимизации существующих подходов к лечению рецидива глиобластомы, что диктует необходимость продолжения исследований. VPA и CXB усиливают влияние ТМЗ на клетки глиобластомы.
Для цитирования:
Пак О.И., Косьянова А.А., Зайцев С.В., Брюховецкий И.С. Вальпроевая кислота и целекоксиб усиливают влияние темозоломида на клетки глиобластомы. Тихоокеанский медицинский журнал. 2024;(4):53-58. https://doi.org/10.34215/1609-1175-2024-4-53-58
For citation:
Pak O.I., Kosianova A.A., Zaitsev S.V., Bryukhovetskiy I.S. Valproic acid and celecoxib enhance the effect of temozolomide on glioblastoma cells. Pacific Medical Journal. 2024;(4):53-58. (In Russ.) https://doi.org/10.34215/1609-1175-2024-4-53-58
Глиобластома – агрессивная первичная опухоль головного мозга человека. Современный протокол комплексного лечения впервые выявленной глиобластомы включает хирургическую операцию, лучевую терапию и цитотоксический препарат темозоломид (ТМЗ), в дозе 75 мг/м2 [1]. Эффективность лечения низкая: несмотря на все усилия врачей, опухоль рецидивирует через 4–8 мес. после удаления [2]. Реоперация и последующая химиотерапия может продлить жизнь пациента [3]. Используется 6–8 циклов ТМЗ с увеличением дозы до 150–200 мг/м2 и далее до 400 мг/м2. Прогноз неблагоприятный. Медиана выживаемости пациентов – 15 мес. [4].
Усиление антиглиомного действия химиотерапии – одно из главных направлений борьбы за жизнь пациента [5]. Клетки рецидивирующей глиобластомы характеризуются снижением степени метилирования ДНК [6] и активацией сигнального пути Wnt/β-катенина, что сопровождается ростом резистентности к ТМЗ. Определенные перспективы для воздействия на эти механизмы имеет комбинация вальпроевой кислоты (VPA) и целекоксиба (CXB).
VPA используется в неврологической практике как противосудорожное средство; противоопухолевое действие препарата связано с ингибированием деацетилаз гистонов, подавлением экспрессии генов slc12a2, slc12a5, slc15a8, fancd2 и rad51 [7], активацией проапоптотических белков TP53-PUMA, окислительно-восстановительным дисбалансом, блокадой жизненного цикла и усилением процессов метилирования ДНК в опухолевых клетках [8]. В свою очередь, CXВ – нестероидное противовоспалительное средство, которое подавляет циклооксигеназу 2 и через сигнальную ось PI3K/Act/ реактивирует GSK-3β, что уменьшает уровень β-катенина и подавляет механизмы симметричного деления, де-стабилизирует энергетический метаболизм, усиливает аутофагию и ухудшает процессы адаптации опухолевых клеток [9].
Цель работы: ретроспективно оценить выживаемость пациентов с рецидивирующей глиобластомой, получавших вальпроевую кислоту, и изучить ее влияние в комбинации с ТМЗ и целекоксибом на опухолевые клетки.
Материалы и методы
Пациенты. Материалом для открытого ретроспективного исследования послужили данные историй болезни 66 пациентов (31 мужчина и 35 женщин), получавших лечение в медицинском комплексе ДВФУ по поводу глиобластомы (МКБ10 – C71) с 2015 по 2020 г. Исследование одобрено Этическим комитетом ДВФУ (протокол № 7 от 08.06.2023 г.).
Опухолевые клетки. В работе использованы стандартные линии клеток глиобластомы: U-87 MG (HTB-14™), T98G (CRL-1690™) и инвазивной злокачественной глиомы С6 (CCL-107™), полученные от производителя, компании ATCC (American Type Cell Collection, US). Характеристики опухолевых клеток (ОК) соответствовали паспортным параметрам и подтверждались сертификатами соответствия ISO 9001, ISO 13485, ISO/IEC 17025 и ISO 17034. Все клеточные линии перед использованием протестированы на контаминацию микоплазмой с помощью Universal Mycoplasma Detection Kit (ATCC® 30-1012K™).
Лекарственные субстанции: темозоломид (T2577), вальпроевая кислота (PHR2614), целекоксиб (169590-42-5) производства компании Sigma Aldrich.
Реагенты для культивирования опухолевых клеток. Культуральная среда Игла, модифицированная Дульбекко (Dulbecco's Modified Eagle's Medium – DMEM, кат. № 21068028); антибиотик-антимикотик 100X: 10000 уд.ед./мл пенициллин/стрептомицин, 25 мкг/мл фунгизона (кат. № 15240096); эмбриональная телячья сыворотка (FBS кат. № 16000044); Трипсин, модифицированный ЭДТА (0,25% кат. № 25200056). Реагенты производства компании Gibco (США).
Экспериментальные животные. В работе использовано 75 крыс породы Вистар, массой 200–250 г. Содержание и уход за животными осуществляли в соответствии с требованиями законодательства РФ. Эксперимент in vivo одобрен Локальным этическим комитетом ДВФУ (протокол № 8 от 08.06.2023 г.).
Метод ретроспективного анализа. Возраст и пол пациентов, локализация опухоли, наличие в анамнезе хирургического лечения, химиолучевой терапии (ХЛТ), прием VPA и CXВ были основными параметрами анализа. Особое внимание уделялось выживаемости пациентов, сбор данных о пациентах проводился с соблюдением требований медицинской этики и деонтологии.
Метод культивирования опухолевых клеток. Опухолевые клетки культивировали в среде DMEM, с добавлением 10% FBS, 100 уд. ед/мл антибиотика-антимикотика 100X при стандартных условиях 37 ºC и 5% CO2 до достижения 80% конфлюэнтности монослоя. Адгезировавшие клетки снимали с помощью ферментативной диссоциации (0,05% trypsin-EDTA, 1 : 4 в стандартных условиях, 5 мин.) и центрифугировали (120 g, 3 мин.), сливали надосадочную жидкость, добавляли свежую среду, ресуспендировали и после 3-го пассажа использовали в эксперименте.
Фармакологическое тестирование in vitro. Опухолевые клетки в количестве 3 × 104 высевали в 24-луночные планшеты, культивировали 24 ч, затем среду меняли на новую, добавляли тестируемые субстанции в концентрациях полумаксимального ингибирования и культивировали 48 ч. Жизнеспособность клеток оценивали с помощью МТТ-теста согласно протоколу производителя. Необработанные клетки использовали в качестве контроля.
Моделирование глиомы in vivo. Животных наркотизировали путем в/б введения смеси (содержащей 200 мкл Золетил/Рометар 1:4); 0,5 × 106 опухолевых клеток линии С6 имплантировали в мозг с помощью стереотаксического аппарата (Narishige, Токио, Япония) в соответствии с координатами: Ар-1; Л 3,0; V 4,5, ТБС-2,4 мм. Опухолевые клетки вводили шприцем Hamilton со скоростью 5 мкл/мин. Опухоль подтверждали через 10 дней с помощью магнитно-резонансной томографии (МРТ).
Метод нейровизуализационного исследования. МРТ проводили на МР-томографе «Bruker's PharmaScan®» (Массачусетс, США) под общим наркозом с применением специальной магнитной катушки для мелких лабораторных животных.
Метод экспериментальной терапии in vivo. Для проведения исследования сформировано 5 групп (n = 15). Животных контрольной группы (группа I) оставляли без лечения. Крыс группы ХЛТ (группа II) облучали в дозе 20 Гр с помощью установки TrueBeam (Varian Medical Systems, США). ТМЗ давали перорально исходя из дозы 30 мг/кг с 1-го по 6-й день эксперимента. Животным группы VPA (группа III) и CXB (группа VI) проводили лучевую и химиотерапию согласно описанному выше протоколу, VPA вводили в/б в дозе 300 мг/кг; CXB давали перорально исходя из расчета 30 мг/кг. Крысам группы VPA + CXB (группа VI) в дополнение к химиолучевой терапии вводили оба препарат одновременно.
Статистическая обработка. Полученные данные подвергали обработке с использованием пакета Graph Pad Prism 4.00. Результаты представлены на графиках «ящик с усами»: отражены медианы, нижние и верхние квартили, минимальное и максимальное значения. Для выявления различий между группами и комбинациями веществ на различных опухолевых линиях проводили дисперсионный анализ. Попарные сравнения проводились t-критерием Стьюдента. Для сравнения медиан групп IC50 был использован критерий Краскела – Уоллиса. Различия считали достоверными при p < 0,05. Анализ выживаемости проводили по методу Каплана – Майера.
Результаты исследования
Ретроспективное клиническое исследование
Согласно данным ретроспективного анализа, средний возраст пациентов на момент нахождения в стационаре составил 55 ± 11,6 года. У 97 % пациентов отмечена супратенториальная локализация опухоли (рис. 1А), которая чаще поражала правую гемисферу (рис. 1Б), причем в более 40% случаев распространялась на две и более доли мозга (МКБ10 – C71.8) (рис. 1В).
Ретроспективный анализ выполнен в три этапа (рис. 1Г). На первом из выборки были исключены 39 пациентов с глиобластомой, которые были прооперированы впервые. На втором этапе из выборки были исключены 9 пациентов, в силу различных причин не получавших лучевой и последующей терапии ТМЗ. На третьем этапе анализа выборка составила 18 человек, госпитализированных для реоперации по поводу рецидива опухоли: в их числе выявлено 11 пациентов, систематически принимавших VPА в дозе до 1000 мг в сутки, остальные 7 пациентов не принимали VPA и составили контрольную группу. Медиана выживаемости пациентов с глиобластомой, принимавших VPA, составила 22 мес; у пациентов контрольной группы, не получавших VPA, – 13 мес (рис. 1Д).
Экспериментальное исследование in vitro
Концентрация полумаксимального ингибирования (IC50) VPA для клеток глиобластомы линий U87MG и T98G составила 1510 и 3900 μM; для линии С6 – 3600 μM (рис. 2А). IC50 CXB для линий U87MG и T98G составила 30,1 и 41,07 μM, для опухолевых клеток линии С6 – 48,4 μM (рис. 2Б). ТМЗ в концентрации 844 μM вызывал гибель половины популяции опухолевых клеток линии U87MG. В отношении опухолевых клеток линии C6 и T98G показатель IC50 составил 541,2 и 435,3 μM (рис. 2В). VPA достоверно усиливала антиглиомный эффект ТМЗ в отношении опухолевых клеток лини U87 (рис. 2Г), наибольшей восприимчивостью к действию комбинации CXB c ТМЗ обладали опухолевые клетки линии С6 и T98G. Комбинированное применение VPA и CXB с ТМЗ оказывало достоверное антиглиомное действие, выраженное в отношении всех протестированных линий.
Экспериментальное исследование in vivo
Для создания модели глиобластомы in vitro использована методика имплантации опухолевых клеток глиомы С6 в мозг иммунокомпетентных крыс породы Вистар. Опухоль, воспроизведенная в эксперименте, характеризуется инфильтративным ростом, ангиогенезом и формированием неопластического узла с центральным некрозом, хорошо визуализируемыми при МРТ на 14-й день наблюдений. К 28-му дню эксперимента размер опухолевого узла существенно различался у животных различных групп (рис. 3А). Химиотерапия ТМЗ в сочетании с лучевой терапией в суммарной дозе 20 Гр сопровождалась достоверным циторедукционным эффектом. В группе I к 28-му дню наблюдений опухоль занимала большую часть полушария мозга, что сопровождалось сдавлением, отеком и дислокацией срединных структур мозга, средний размер опухоли составил 233,13 ± 17,11 мм3, в группе II размер опухоли был 123,67 ± 8,8 мм3, что достоверно (р < 0,05) меньше, чем в контроле. Добавление в схему лечения VPA и CXB приводило к уменьшению объема опухоли, а комбинация данных лекарственных средств сопровождалась увеличением выживаемости экспериментальных животных, что подтверждает результаты клинических наблюдений. У крыс группы III и IV размер опухолевого узла достоверно отличался от животных из группы II и составил 82,23 ± 6,7мм3 и 85,13 ± 5,3мм3 соответственно. В группе V размер опухоли составил 60,1 ± 4,1 мм3. Медиана выживаемости экспериментальных животных группы I составила 24,5 дней, группы II – 44 дня, а группы III и IV составила 55 и 58 дней, в группе V – 65 дней (рис. 3Б).
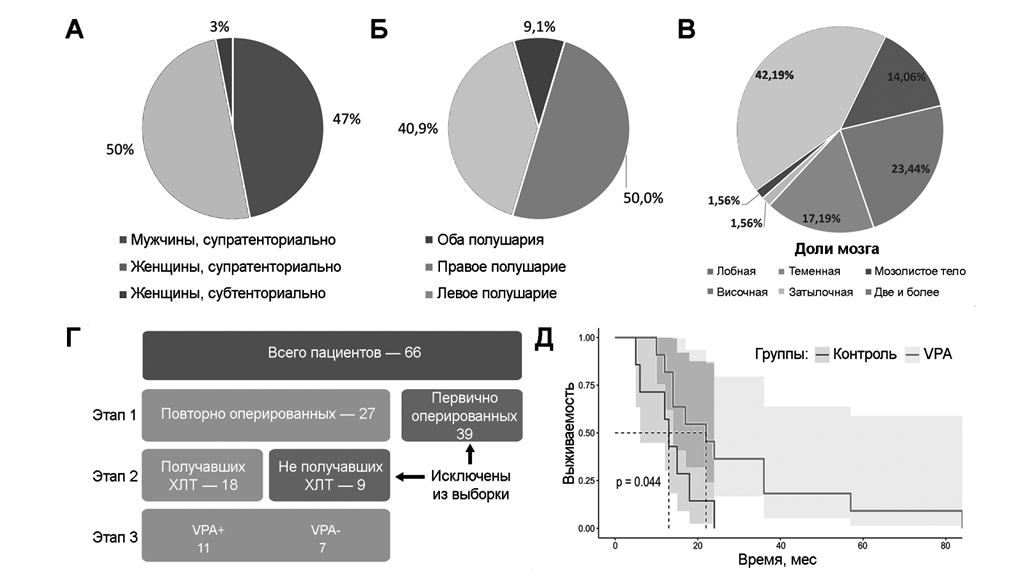
Рис. 1. Характеристика пациентов, участвовавших в ретроспективном исследовании: соотношение мужчин и женщин с супратенториальной глиобластомой (А), локализация опухоли по отношению к полушариям (Б) и долям мозга (В), критерии отбора пациентов для исследования (Г), выживаемость пациентов с глиобластомой, получавших VPA (E).
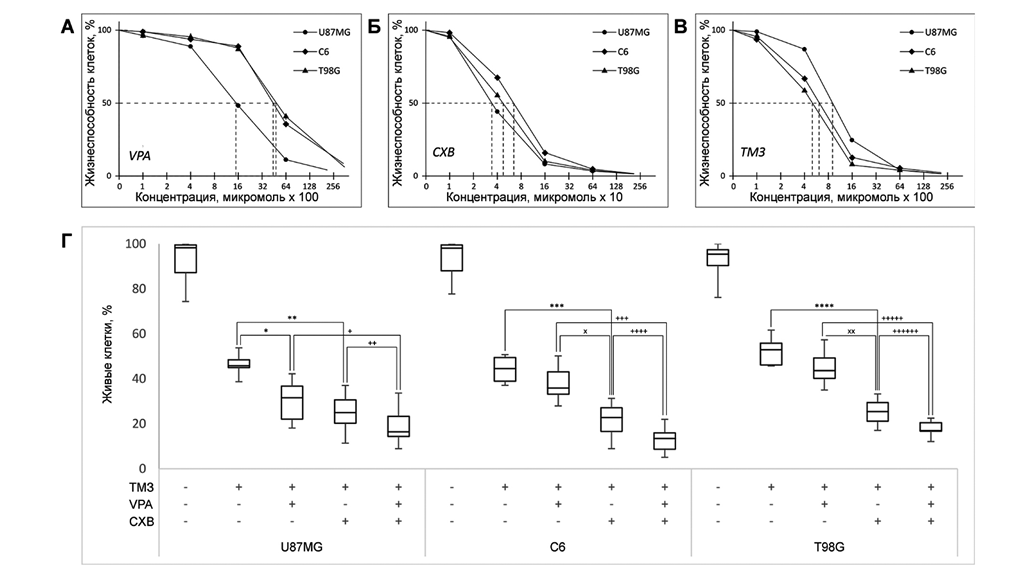
Рис. 2. Результаты экспериментального исследования in vitro: IC50 вальпроевой кислоты (А), целекоксиба (Б), темозоломида (В) и комбинации лекарственных средств (Г) в отношении различных клеточных линий глиобластомы. Усиление антиглиомной активности наблюдалось при комбинации VPA с ТМЗ на клетках линии U87 (*), в то же время на клетках двух других линий достоверного различия не было. Комбинация с CXB достоверно (**, ***, ****) усиливала антиглиомное действие ТМЗ в отношении всех протестированных линий. Комбинация VPA и CXB с ТМЗ оказывала более выраженное антиглиомное действие по сравнению с комбинациями ТМЗ с веществами по отдельности (+, ++, +++, ++++, +++++, ++++++).
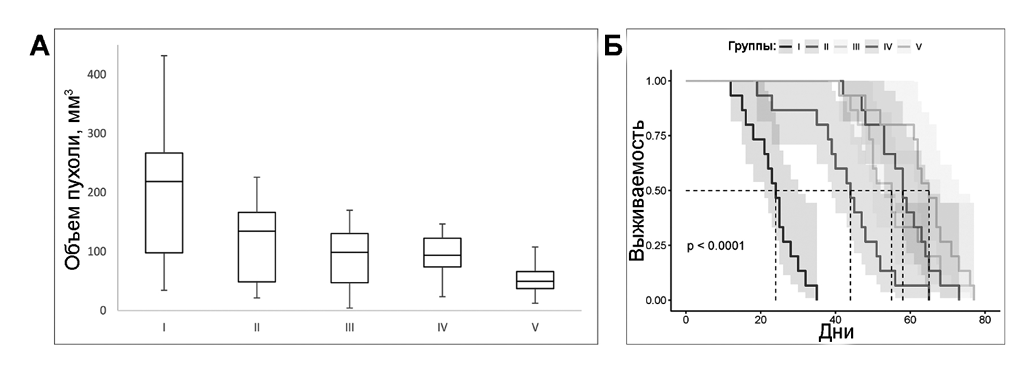
Рис. 3. Динамика объёма опухоли в ходе эксперимента in vivo: средний размер опухоли в мозге (А) и выживаемость (Б) экспериментальных животных.
Обсуждение полученных результатов
Средний возраст пациентов с глиобластомой, задействованных в нашем исследовании, соответствует данным мировой статистики: в большинстве случаев опухоль выявлялась во второй половине жизни одинаково часто как у женщин, так и у мужчин. Хирургическая операция и химиолучевая терапия были и остаются безальтернативными методами лечения глиобластомы, способными обеспечить значимый выигрыш в продолжительности жизни [10].
Отказ хотя бы от одного из компонентов этой программы ограничивает возможности пациентов. В связи с этим для участия в исследовании нами были отобраны только 18 пациентов, получивших полный курс лечения по протоколу Роджера Ступпа и госпитализированных с рецидивом для реоперации, из которых 11 человек получали VPA по поводу судорожных припадков.
Результаты исследования позволяют утверждать, что комбинация VPA с ТМЗ увеличивает выживаемость пациентов, реоперированных по поводу рецидива глиобластомы (p = 0,044). Медиана общей выживаемости пациентов, получавших VPA в нашем исследовании, – 22 месяца, что объективно больше, чем у контрольных пациентов. Безусловно, наше исследование выполнено на небольшом контингенте пациентов, однако оно позволяет уточнить и дополнить данные Peng-Yi Lee, связавшего прием противосудорожных средств после адъювантной химиотерапии с более благоприятным прогнозом [11]. Наши данные не противоречат сообщениям Deepthi Valiyaveettil [12] о большей медиане общей выживаемости пациентов с глиобластомой, получивших полный курс химиолучевого лечения в комбинации с VPA. Увеличение общей выживаемости при комбинации лучевой терапии и ТМЗ с VPA описано Shinichi Watanabe [13], что дополнительно подтверждается результатами эксперимента in vitro и in vivo.
Как следует из эксперимента, VPA достоверно усиливала антиглиомный эффект ТМЗ в отношении опухолевых клеток лини U87, однако важнейшей особенностью нашего исследования стала комбинация VPA c CXB, ранее показавшая антиглиомный эффект в сочетании c Wnt-ингибирующей активностью [9]. Прием CXB с первого дня химиолучевой терапии является вмешательством с низким риском и разумным основанием, что особенно актуально в силу сообщений о способности VPA активировать Wnt-сигналинг в клетках глиобластомы [14].
В эксперименте in vitro клетки линии C6 обладали довольно высокой чувствительностью к ТМЗ (рис. 2В). Линия С6 полностью воспроизводит патофизиологические механизмы опухолевого процесса в организме иммунокомпетентных животных [15]. Подобная динамика была характерна и для клеток глиобластомы человека. Конечно, клетки глиобластомы линии U87 обладали более низкой чувствительностью к ТМЗ, однако его цитостатическое действие возрастало в комбинации VPA, что указывает на большую значимость процессов ацетилирования гистонов в регуляции их жизненных процессов [16][17].
Вероятно, наблюдаемое нами усиление цитотоксического действия ТМЗ в отношении опухолевых клеток линии С6 и T98G в комбинации с CXB объясняется высоким содержанием в данных культурах опухолевых стволовых клеток. Особо заслуживает внимания тот факт, что все протестированные линии хорошо откликалась на комбинацию VPA и CXB, что, вероятно, может указывать на существенное расширение антиглиомных возможностей такой комбинации в отношении низкодифференцированных опухолевых клеток.
Выводы
VPA увеличивает выживаемость пациентов с глио-бластомой и в комбинации с CXB усиливает противоопухолевое действие ТМЗ в эксперименте in vitro и in vivo. Высокий антиглиомный потенциал комбинации VPA и CXB с ТМЗ открывает перспективы ее использования для оптимизации существующих подходов к лечению рецидива глиобластомы.
Список литературы
1. McMahon DJ, Gleeson JP, O'Reilly S, Bambury RM. Management of newly diagnosed glioblastoma multiforme: current state of the art and emerging therapeutic approaches. Medical Oncology. 2022;39(9):129. doi: 10.1007/s12032-022-01708-w
2. Obrador E, Moreno-Murciano P, Oriol-Caballo M, López-Blanch R, Pineda B, Gutiérrez-Arroyo JL, Loras A, Gonzalez-Bonet LG, Martinez-Cadenas C, Estrela JM, Marqués-Torrejón MÁ. Glioblastoma Therapy: Past, Present and Future. International Journal of Molecular Sciences. 2024;25(5):2529. doi: 10.3390/ijms25052529
3. Vaz-Salgado MA, Villamayor M, Albarrán V, Alía V, Sotoca P, Chamorro J, Rosero D, Barrill AM, Martín M, Fernandez E, Gutierrez JA, Rojas-Medina LM, Ley L. Recurrent Glioblastoma : A Review of the Treatment Options. Cancers (Basel). 2023; 15(17):4279. doi: 10.3390/cancers15174279
4. Karve AS, Desai JM, Gadgil SN, Dave N, Wise-Draper TM, Gudelsky GA, Phoenix TN, DasGupta B, Yogendran L, Sengupta S, Plas DR, Desai PB. A Review of Approaches to Potentiate the Activity of Temozolomide against Glioblastoma to Overcome Resistance. International Journal of Molecular Sciences. 2024;25(6):3217. doi: 10.3390/ijms25063217
5. Valerius AR, Webb LM, Sener U. Novel Clinical Trials and Approaches in the Management of Glioblastoma. Current Oncology Reports. 2024;26(5):439–465. doi: 10.1007/s11912-024-01519-4
6. Drexler R, Khatri R, Schüller U, Eckhardt A, Ryba A, Sauvigny T, Dührsen L, Mohme M, Ricklefs T, Bode H, Hausmann F, Huber TB, Bonn S, Voß H, Neumann JE, Silverbush D, Hovestadt V, Suvà ML, Lamszus K, Gempt J, Westphal M, Heiland DH, Hänzelmann S, Ricklefs FL. Temporal change of DNA methylation subclasses between matched newly diagnosed and recurrent glioblastoma. Acta Neuropathologica. 2024;147(1):21. doi: 10.1007/s00401-023-02677-8
7. Damanskienė E, Balnytė I, Valančiūtė A, Alonso MM, Stakišaitis D. Different Effects of Valproic Acid on SLC12A2, SLC12A5 and SLC5A8 Gene Expression in Pediatric Glioblastoma Cells as an Approach to Personalised Therapy. Biomedicines. 2022;10(5):968. doi: 10.3390/biomedicines10050968
8. Barciszewska AM, Belter A, Gawrońska I, Giel-Pietraszuk M, Naskręt-Barciszewska MZ. Cross-reactivity between histone demethylase inhibitor valproic acid and DNA methylation in glioblastoma cell lines. Frontiers in Oncology. 2022;12:1033035. doi: 10.3389/fonc.2022.1033035
9. Lombardi F, Augello FR, Artone S, Ciafarone A, Topi S, Cifone MG, Cinque B, Palumbo P. Involvement of Cyclooxygenase-2 in Establishing an Immunosuppressive Microenvironment in Tumorspheres Derived from ТМЗ-Resistant Glioblastoma Cell Lines and Primary Cultures. Cells. 2024;13(3):258. doi: 10.3390/cells13030258
10. van den Bent MJ, Geurts M, French PJ, Smits M, Capper D, Bromberg JEC, Chang SM. Primary brain tumours in adults. Lancet. 2023;402(10412):1564–1579. doi: 10.1016/S0140-6736(23)01054-1
11. Lee PY, Wei YT, Chao KC, Chu CN, Chung WH, Wang TH. Anti-epileptic drug use during adjuvant chemo-radiotherapy is associated with poorer survival in patients with glioblastoma: A nationwide population-based cohort study. Journal of Cancer Research and Therapeutics. 2024;20(2):555–562. doi: 10.4103/jcrt.jcrt_750_22
12. Valiyaveettil D, Malik M, Joseph DM, Ahmed SF, Kothwal SA, Vijayasaradhi M. Effect of valproic acid on survival in glioblastoma: A prospective single-arm study. South Asian J Cancer. 2018 Jul-Sep;7(3):159–162. doi: 10.4103/sajc.sajc_188_17
13. Watanabe S, Kuwabara Y, Suehiro S, Yamashita D, Tanaka M, Tanaka A, Ohue S, Araki H. Valproic acid reduces hair loss and improves survival in patients receiving temozolomide-based radiation therapy for high-grade glioma. Eur J Clin Pharmacol. 2017 Mar;73(3):357–363. doi: 10.1007/s00228-016-2167-1. Epub 2016 Nov 26. PMID: 27889835.
14. Ma S, Guo Z, Wang B, Yang M, Yuan X, Ji B, Wu Y, Chen S. A Computational Framework to Identify Biomarkers for Glioma Recurrence and Potential Drugs Targeting Them. Frontiers in Genetics. 2022;12:832627. doi: 10.3389/fgene.2021.832627
15. Sahu U, Barth RF, Otani Y, McCormack R, Kaur B. Rat and Mouse Brain Tumor Models for Experimental Neuro-Oncology Research. Journal of Neuropathology & Experimental Neurology. 2022;81(5):312–329. doi: 10.1093/jnen/nlac021
16. Liang SP, Wang XZ, Piao MH, Chen X, Wang ZC, Li C, Wang YB, Lu S, He C, Wang YL, Chi GF, Ge PF. Activated SIRT1 contributes to DPT-induced glioma cell parthanatos by upregulation of NOX2 and NAT10. Acta Pharmacologica Sinica. 2023;44(10):2125–2138. doi: 10.1038/s41401-023-01109-3
17. Chang HH, Chang YY, Tsai BC, Chen LJ, Chang AC, Chuang JY, Gean PW, Hsueh YS. A Selective Histone Deacetylase Inhibitor Induces Autophagy and Cell Death via SCNN1A Downregulation in Glioblastoma Cells. Cancers (Basel). 2022;14(18):4537. doi: 10.3390/cancers14184537
Об авторах
О. И. ПакРоссия
Владивосток
А. А. Косьянова
Россия
Владивосток
С. В. Зайцев
Россия
Сергей Викторович Зайцев, канд. биол. наук., зав. лабораторией, доцент
лаборатория молекулярной и клеточной нейробиологии
690922; п. Аякс, 10; Приморский край; о. Русский; Владивосток
тел.: +7 (914) 702-77-37
И. С. Брюховецкий
Россия
Владивосток
Рецензия
Для цитирования:
Пак О.И., Косьянова А.А., Зайцев С.В., Брюховецкий И.С. Вальпроевая кислота и целекоксиб усиливают влияние темозоломида на клетки глиобластомы. Тихоокеанский медицинский журнал. 2024;(4):53-58. https://doi.org/10.34215/1609-1175-2024-4-53-58
For citation:
Pak O.I., Kosianova A.A., Zaitsev S.V., Bryukhovetskiy I.S. Valproic acid and celecoxib enhance the effect of temozolomide on glioblastoma cells. Pacific Medical Journal. 2024;(4):53-58. (In Russ.) https://doi.org/10.34215/1609-1175-2024-4-53-58





































