Перейти к:
Виром мумии ископаемого волка (Canis lupus) как потенциальный источник вирулентных бактериофагов для фаготерапии
https://doi.org/10.34215/1609-1175-2023-1-35-37
Аннотация
Цель: изучение перспектив поиска новых вирулентных бактериофагов в палеонтологическом материале, извлеченном из зоны вечной мерзлоты.
Материал и методы. Методом шотган-метагеномного секвенирования оценена структура вирома содержимого толстой кишки мумии щенка волка (Canis lupus) периода позднего плейстоцена.
Результаты. В исследовании продемонстрировано преобладание в структуре изученного вирома хвостатых бактериофагов семейства Myoviridae, включая группу PhiKZ-подобных фагов.
Заключение. Результаты исследования свидетельствуют о возможности использования палеонтологического материала, сохраняющегося в древней мерзлоте Арктики, в качестве ресурса для поиска и выделения новых вирулентных бактериофагов.
Для цитирования:
Гончаров А.Е., Ахременко Я.А., Азаров Д.В., Чепрасов М.Ю., Федоров С.Е., Соломенный А.П., Колоджиева В.В. Виром мумии ископаемого волка (Canis lupus) как потенциальный источник вирулентных бактериофагов для фаготерапии. Тихоокеанский медицинский журнал. 2023;(1):35-37. https://doi.org/10.34215/1609-1175-2023-1-35-37
For citation:
Goncharov A.E., Ahremenko Ya.A., Azarov D.V., Cheprasov M.J., Fedorov S.E., Solomenny A.P., Kolodzhieva V.V. Virome of ancient wolf mummy (Canis lupus) as a potential source of virulent bacteriophages for phage therapy. Pacific Medical Journal. 2023;(1):35-37. (In Russ.) https://doi.org/10.34215/1609-1175-2023-1-35-37
В настоящее время отмечается неуклонный рост числа исследований, посвященных оценке биологического разнообразия бактериофагов, что в значительной мере определяется возможностью использования данных вирусов в качестве лечебных и профилактических средств для борьбы с инфекциями, обусловленными мультирезистентными к антимикробным препаратам бактериями.
При изучении фаговых виромов в различных типах биологического материала активно применяются метагеномные методы исследования. Использование достижений метагеномики привело к парадоксальным результатам, которые позволили переосмыслить значение отдельных природных биомов в качестве источника бактериофагов. В частности, оказалось, что наиболее разнообразными по таксономическому и генетическому составу являются фаги экстремальных криогенных местообитаний, таких как арктические многолетнемерзлые почвы, водные экосистемы Арктики, Антарктики и ледники горных систем [1][2].
Кроме того, продемонстрировано [2], что микробиота, сохраняющаяся в реликтовых криогенных средах, представляет собой резервуар новых ранее не описанных таксонов бактериофагов.
В данной работе мы приводим результаты метагеномного анализа древнего микробного сообщества, ассоциированного с пищеварительным трактом ископаемого животного, законсервированного в многолетней мерзлоте на протяжении более чем 12 000-летнего периода. Целью проведенного анализа являлась оценка структуры вирома с точки зрения перспектив поиска новых вирулентных бактериофаговв биологическом материале данного типа.
Материал и методы
Методом шотган-метагеномного секвенирования изучен фаговый виром содержимого толстой кишки палеонтологического объекта «туматский щенок». Материал представляет собой мерзлую мумию щенка волка или собаки (Canis lupus), найденную экспедицией НИИПЭС СВФУ в местонахождении Сыалах (71°00'27.75" с. ш., 139°53'20.01" в. д.) расположенном в 45 км к северо-востоку от с. Тумат Усть-Янского улуса (района) Республики Саха (Якутия). Проведенное радиоуглеродное датирование данной мумии (12 460 ± 50 лет (GRA-52435)) позволяет предположить поздний неоплейстоценовый возраст находки [3].
Образцы содержимого толстой кишки получали в асептических условиях при некропсии мумии в лаборатории «Музей мамонта им. П.А. Лазарева» НИИ прикладной экологии Севера СВФУ им. М.К. Аммосова. Выделение ДНК из данного материала проводили с использованием DNeasy Powersoil Pro (Qiagen), при этом для получения 50 мкл ДНК концентрацией 32 нг/мкл из пробы объемом 2 г использовали 8 колонок.
Библиотеку фрагментов ДНК готовили с использованием набора реагентов Illumina Nextera XT DNA Sample Prep Kit (Illumina, США) согласно инструкции производителя. Качество полученной библиотеки оценивали с помощью анализатора Agilent Bioanalyzer 2100 (Agilent Technologies, США). Ампликоны метили Nextera XT Index Kit (Illumina) согласно инструкции производителя.
Метагеномное секвенирование методом «дробовика» проводилось на приборе HiSeq 2500 Sequencing System/ Illumina в ресурсном центре «Биобанк» СПбГУ с использованием HiSeq 2500 Sequencing Kitсогласно инструктивной документации производителя.
Анализ качества прочтений секвенирования проводился с помощью программы FastQC (https://www.bioinformatics.babraham.ac.uk/projects/fastqc). Подготовка прочтений секвенирования проводилась спомощью программы Trimmomatic v.0.39 (http://www.usadellab.org/cms/?page=trimmomatic). Сборка контигов de novo проводилась с использованием SPAdes v. 3.15.3 с опцией metaspade с последующим бинингом контигов в MaxBin 2.2.7 (https://sourceforge.net/projects/maxbin2). Контроль качества сборок проводили в QUAST v. 5.0.2 (https://cab.spbu.ru/software/quast/). Аннотация метагеномных образцов осуществлялась с помощью онлайн-сервисов CCMetagen 1.3 (https://cge.cbs.dtu.dk/services/CCMetagen) и MG-RAST (www.mg-rast.org ).
Результаты исследования
В результате метагеномного секвенирования получено 7 682 400 прочтений (34 885 634 пар оснований), из которых было сформировано 11 894 контига средним размером 2933 пары нуклеотидов.
В структуре микробиома из числа прокариот существенным образом представлены ризосферные и почвенные микроорганизмы, в частности бактерии родов Pseudomonadaceae и Clostridiaceae (рис.). Данное обстоятельство, вероятно, объясняется возможностью заглатывания животным растений с частичками почвы при жизни или попаданием частиц грунта в пищеварительный тракт в процессе захоронения.
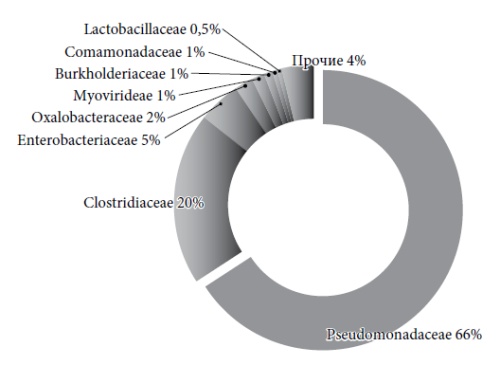
Рис. Структура кишечного микробиома «туматского щенка» на уровне семейств.
Установлено также, что последовательности ДНК бактериофагов семейства Myoviridae широко представлены в составе данного микробиома, составляя 1,48% от общего числа аннотированных последовательностей (рис.).
Из числа идентифицированных родов бактериофагов преобладают вирулентные хвостатые phiKZ-подобные фаги, которые составляют 1,4% (111 последовательностей) в структуре всех последовательностей, соответствующих родам микроорганизмов.
Следует отметить обилие последовательностей бактериофагов семейств Myoviridae, Podoviridae, Siphoviridae неясного таксономического статуса.
Обсуждение полученных данных
В структуре вирома мерзлой мумии щенка волка преобладают хвостатые бактериофаги семейства Myoviridae. Эти данные соответствуют результатам ранее проведенных исследований, указывающих на изобилие фаговых последовательностей в арктических микробиомах [1].
PhiKZ-подобные бактериофаги, последовательности которых были выявлены в ходе нашего исследования, относятся к нетаксономической группе так называемых «джамбо-фагов» (jumbo phages). Общей чертой данных бактериофагов, описанных у псевдомонад [4], является наличие крупного генома, способность к образованию «псевдоядер» в цитоплазме бактериальной клетки и наличие мощной неспецифической защиты от бактериальных систем CRISPR/Cas, что делает эти вирусы перспективными для практического использования в составе терапевтических бактериофаговых препаратов [5][6].
Перспективы дальнейших исследований связаны с поиском интактных бактериофагов, прежде всего псевдомонадных, в образцах палеонтологического материала и определением их биологических свойств, а также круга хозяев. Следует отметить, что в настоящее время считается доказанным факт, что крупные ДНК-содержащие вирусы могут сохранять контагиозность при консервации в многолетнемерзлых породах на протяжении десятков тысяч лет [7][8].
Заключение
Результаты метагеномного анализа микробиома «туматского щенка», описанные в настоящем исследовании, свидетельствуют о возможности использования палеонтологического материала, сохраняющегося в древней мерзлоте Арктики, в качестве ресурса для поиска и выделения новых бактериофагов, имеющих перспективы применения в качестве антибактериальных агентов или объектов биотехнологии.
Конфликт интересов: авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Источник финансирования: научное исследование (публикация статьи) выполнено при финансовой поддержке гранта РФФИ № 20-29-01043 («Древняя ДНК»).
Участие авторов:
Концепция и дизайн исследования – АЕГ
Сбор и обработка материала – МЮЧ, СЕФ, ЯАА, ДВА, ВВК, АПС
Написание текста – АЕГ
Редактирование – ЯАА
Список литературы
1. Kerfahi D, Tripathi BM, Dong K, Kim M, Kim H, Slik JF, Adams JM. From the high Arctic to the equator: do soil metagenomes differ according to our expectations? Microbial ecology, 2019;77(1):168–85. doi: 10.1007/s00248-018-1215-z
2. Zablocki O, van Zyl L, Adriaenssens EM, Rubagotti E, Tuffin M, Cary SC, Cowan DA. High-level diversity of tailed Phages, eukaryote-associated viruses, and virophage-like elements in the metaviromes of Antarctic soils. Appl Environ Microbiol 2014;80(22):6888–97. doi: 10.1128/AEM.01525-14
3. López-Bueno A, Tamames J, Velazquez D, Moya A, Quesada A, Alcami A High diversity of the viral community from an Antarctic Lake. Science 2009;326:858–61. doi: 10.1126/science.1179287
4. Григорьев С. Е., Чепрасов М.Ю., Савинов Г.Н., Тихонов А.Н., Новгородов Г.П., Федоров С.Е., Боескоров Г.Г., Протопопов А.В., Плотников В.В., Боголюбский И.Н., Протодьяконов К.Е., ван дер Плихт Й. Палеонтологические и археозоологические исследования в бассейне р. Яна. Вестник Северо-Восточного федерального университета им. М.К. Аммосова. 2017;1(57):20–35.
5. Danilova YA, Belousova VV, Moiseenko AV, Vishnyakov IE, Yakunina MV, Sokolova OS. Maturation of Pseudo-Nucleus Compartment in P. aeruginosa, Infected with Giant phiKZ Phage. Viruses. 2020;12:1197. doi: 10.3390/v12101197
6. Chaikeeratisak V, Nguyen K, Egan ME, Erb ML, Vavilina A, Pogliano J The phage nucleus and tubulin spindle are conserved among large pseudomonas phages. Cell Reports. 2017;20:1563–71. doi: 10.1016/j.celrep.2017.07.064
7. Malone LM, Warring SL, Jackson SA, Warnecke C, Gardner PP, Gumy LF, Fineran PC A jumbo phage that forms a nucleus-like structure evades CRISPR–Cas DNA targeting but is vulnerable to type III RNA-based immunity. Nat Microbiol. 2020;5:48–55. doi: 10.1038/s41564-019-0612-5
8. Legendre M, Bartoli J, Shmakova L, Jeudy S, Labadie K, Adrait A, Lescot M, Poirot O, Bertaux L, Bruley C, Couté Y, Rivkina E, Abergel C, Claverie JM. Thirty-thousand-year-old distant relative of giant icosahedral DNA viruses with a Pandoravirus morphology. Proc. Natl. Acad. Sci. USA. 2014;111(11):4274–9. doi: 10.1073/pnas.1320670111.488
9. Legendre M, Lartigue A, Bertaux L, Jeudy S, Bartoli J, Lescot M, Alempic JM, Ramus C, Bruley C, Labadie K, Shmakova L, Rivkina, E, Couté Y, Abergel C. Claverie JM. In-depth study of Mollivirus sibericum, a new 30,000-y-old 490 giant virus infecting Acanthamoeba. Proc. Natl. Acad. Sci. USA. 2015;112(38):5327–35. doi: 10.1073/pnas.1510795112
Об авторах
А. Е. ГончаровРоссия
Санкт-Петербург
Я. А. Ахременко
Россия
Ахременко Яна Александровна – доцент кафедры гистологии и микробиологии Медицинского института
677007, Республика Саха (Якутия), г. Якутск, ул. Ойунского, 27
Д. В. Азаров
Россия
Санкт-Петербург
М. Ю. Чепрасов
Россия
Якутск
С. Е. Федоров
Россия
Якутск
А. П. Соломенный
Россия
Пермь
В. В. Колоджиева
Россия
Рецензия
Для цитирования:
Гончаров А.Е., Ахременко Я.А., Азаров Д.В., Чепрасов М.Ю., Федоров С.Е., Соломенный А.П., Колоджиева В.В. Виром мумии ископаемого волка (Canis lupus) как потенциальный источник вирулентных бактериофагов для фаготерапии. Тихоокеанский медицинский журнал. 2023;(1):35-37. https://doi.org/10.34215/1609-1175-2023-1-35-37
For citation:
Goncharov A.E., Ahremenko Ya.A., Azarov D.V., Cheprasov M.J., Fedorov S.E., Solomenny A.P., Kolodzhieva V.V. Virome of ancient wolf mummy (Canis lupus) as a potential source of virulent bacteriophages for phage therapy. Pacific Medical Journal. 2023;(1):35-37. (In Russ.) https://doi.org/10.34215/1609-1175-2023-1-35-37





































