Перейти к:
Сравнительная характеристика генотипов интерлейкинов и риски реализации фенотипов бронхиальной астмы у детей
https://doi.org/10.34215/1609-1175-2024-1-5-10
Аннотация
В статье представлен анализ генетических предикторов развития различных эндотипических и фенотипических вариантов бронхиальной астмы у детей. Обзор данных по структуре и встречаемости однонуклеотидных полиморфизмов генов интерлейкинов показывает их взаимосвязь с риском реализации вирус-индуцированного и аллерген-индуцированного фенотипов бронхиальной астмы. Значимые различия генотипов коррелируют с аберрантной продукцией интерлейкинов и с шансами развития разных фенотипов заболевания. Исследования генетических факторов предоставляет информацию о значимости функциональных полиморфизмов генов интерлейкинов как предикторов, ассоциированных с риском развития и фенотипическими особенностями заболевания.
Ключевые слова
Для цитирования:
Шуматов В.Б., Просекова Е.В., Долгополов М.С., Турянская А.И., Ковальчук В.К., Сабыныч В.А. Сравнительная характеристика генотипов интерлейкинов и риски реализации фенотипов бронхиальной астмы у детей. Тихоокеанский медицинский журнал. 2024;(1):5-10. https://doi.org/10.34215/1609-1175-2024-1-5-10
For citation:
Shumatov V.B., Prosekova E.V., Dolgopolov M.S., Turyanskaya A.I., Kovalchuk V.K., Sabynych V.A. Comparative characterization of interleukin genotypes and risks of bronchial asthma phenotypes in children. Pacific Medical Journal. 2024;(1):5-10. (In Russ.) https://doi.org/10.34215/1609-1175-2024-1-5-10
В последние десятилетия молекулярная диагностика, генетическое и эпигенетическое редактирование, анализ мультиомных данных внесли значительный вклад в определение предикторов, триггеров и патогенетических механизмов заболеваний. Описаны новые эндотипы мультифакториальных заболеваний, среди которых бронхиальная астма характеризуется разными патофизиологическими механизмами [1–5]. Бронхиальная астма является гетерогенным заболеванием, от которого во всем мире страдает более 350 миллионов человек [6].
Генетические факторы играют значительную роль в риске развития бронхиальной астмы, при этом полногеномные ассоциативные исследования показали, что выявленные генетические варианты объясняют только примерно 9% наследственности астмы, что может быть объяснено повышенной пенетрантностью генотипов предрасположенности к астме, факторами окружающей среды, которые проявляют свое влияние через взаимодействие генов и окружающей среды [7][8][9]. Эти данные перенаправили траекторию исследований основных дескрипторов заболеваний от патомеханистического подхода по симптомам и дисфункции органов к распознаванию патогенетических иммунологических, метаболических путей и поиску валидных биомаркеров [1][10][11][12]. Идентификация биомаркеров, способных прогнозировать риски развития и эффективность терапии бронхиальной астмы, являются областью приоритетных научных исследований [13].
Внедрение прецизионной медицины, концепций эндотипов заболеваний, генотипов и региотипов позволяет стратифицировать пациентов на основе патогенетических механизмов заболевания для оптимизации лечения бронхиальной астмы и аллергических заболеваний [10][11][12]. Многообразие патогенетических факторов определяет клинический полиморфизм и гетерогенность бронхиальной астмы, где генетическая предрасположенность реализуется во взаимодействии с факторами окружающей среды и проявляется формированием патологического фенотипа болезни. Идентификация биомаркеров, способных прогнозировать риски фенотипических вариантов болезни и эффективность терапии астмы, является областью интенсивных исследований. Дополнительную информацию могут дать объективные измерения уровней аллерген-специфических IgE, цитокинов и других маркеров различных типов воспаления [14]. Биомаркеры, отражающие патофизиологические (биологические) процессы, необходимы для мониторинга здоровья пациентов, включая клинические признаки и клинико-лабораторные исследования, геномные индексы и другие, которые можно объективно измерить и использовать в качестве индикаторов патофизиологических процессов [15].
Нами проведен анализ генотипов интерлейкинов и содержание в сыворотке крови иммуноглобулина Е у 150 детей с верифицированным диагнозом бронхиальной астмы с разделением на подгруппы в зависимости от фенотипа (вирус-индуцированная (ВБА) и аллерген-индуцированная (АБА) по 75 детей) и 100 детей с первой группой здоровья в возрасте от трех до одиннадцати лет (табл.). Оценка встречаемости однонуклеотидных полиморфизмов генов интерлейкинов у детей с бронхиальной астмой выявила высокую распространенность гомозиготного генотипа интерлейкина 2 (G-330G) и гетерозиготных генотипов следующих интерлейкинов: IL-4 (C-589T), IL-6 (С-174G), IL-10 (С-592A; С-819T; G-1082A), IL-17А (G-197А), IL-17F (T-7488C). В группе здоровых детей генотипы интерлейкинов существенно отличаются. Здесь преобладают IL-2 (Т-330G), IL-4 (С-589С), IL-6 (C-174G), IL-10 (С-592A; С-819С; G-1082G), IL-17А (G-197А), IL-17F (T-7488C).
Анализ взаимосвязей генотипа и продукции интерлейкинов с высокой патогенетической значимостью при бронхиальной астме определил достоверно наиболее высокие уровни содержания интерлейкина у детей с гомозиготными генотипами IL-4 ТТ, IL-6 GG как в группе наблюдения, так и среди здоровых сверстников. Незначительные уровни соответствующих интерлейкинов в сыворотке крови детей определены при наличии гомозиготных генотипов IL-4 СС и IL-6 СС (рис. 1, 2).
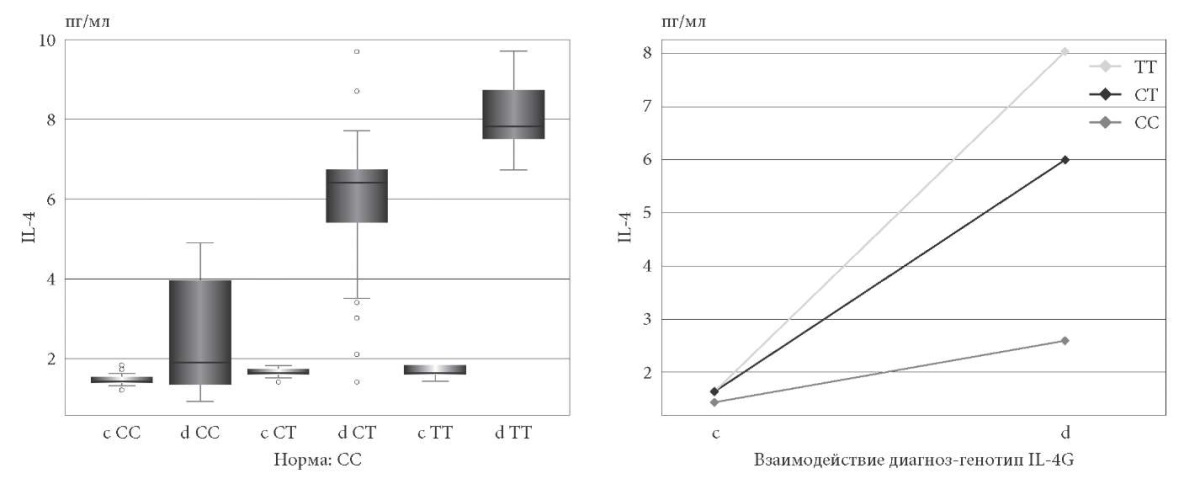
Рис. 1. Корреляции генотипа и содержания в сыворотке крови интерлейкина 4
здоровых сверстников и детей с бронхиальной астмой.
Примечание: c – здоровые дети; d – дети c бронхиальной астмой.
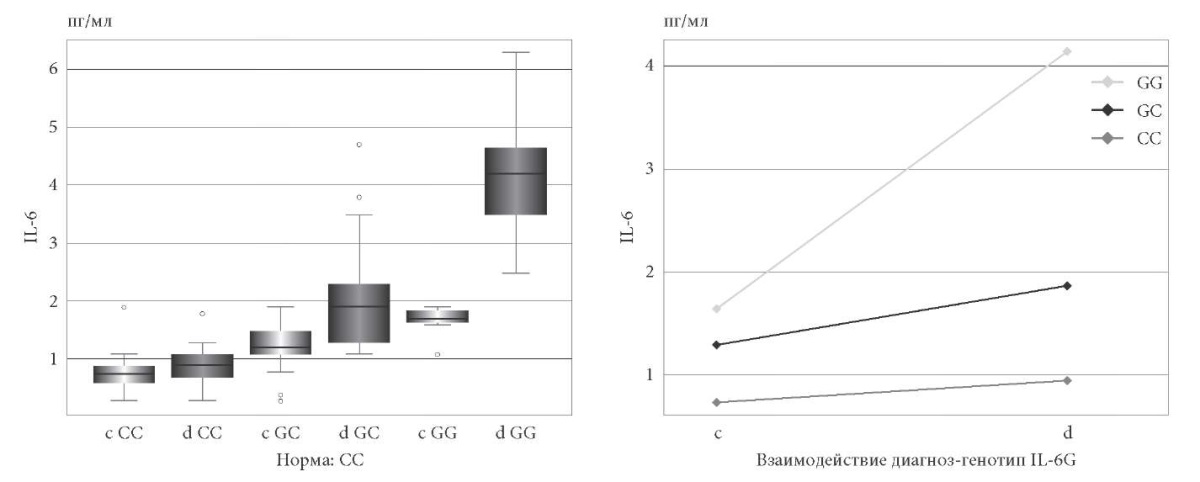
Рис. 2. Ассоциации бронхиальной астмы с генотипом
и содержанием в сыворотке крови интерлейкина 6 у детей.
Примечание: c – здоровые дети; d – дети c бронхиальной астмой.
Проведенные исследования определили статистически значимое влияние генотипа на аберрантную продукцию интерлейкинов. При парном сравнении содержания интерлейкинов 4 и 6 в сыворотке крови и структуры генотипа отмечена гиперпродукция IL-4 у детей при бронхиальной астме с генотипом TT. В группе здоровых сверстников значимо отличается синтез IL-6 при гомозиготных генотипах CС и GG, а у детей при БА с гетерозиготным и гомозиготным генотипами CG и GG (рис. 2).
Анализ ассоциации продукции и полиморфизма генов IL-10 в позициях G-1082A, C-819T и C-592A выявил достоверно значимое влияние генотипа на реализацию заболевания и парное взаимодействие генотипа на продукцию интерлейкина. У здоровых сверстников значимые отличия содержания IL-10 в сыворотке крови отмечены у детей с гомозиготным генотипом: AA и GG, а среди детей с бронхиальной астмой при наличии генотипа GG показатели IL-10 отличаются в группе контроля с любыми генотипами.
Однонаправленные данные выявлены в оценке корреляции генотипа C-819 T и уровня IL-10 в сыворотке крови. Уровни IL-10 в сыворотке крови у детей с генотипом СС отличается от таковых в группе контроля и детей с БА с другими генотипами, а при наличии «мутантного» генотипа ТТ идентичны показателям здоровых детей с любым генотипом. Исследования ассоциации полиморфизма C-592A и синтеза IL-10 значимых отличий в зависимости от генотипа не выявили.
Высокие показатели IL-17А в сыворотке крови определены у детей с генотипом АА и среди здоровых, и при бронхиальной астме, наименьшее содержание данного интерлейкина у детей отмечено при наличии гомозиготного генотипа GG. Значимые различия в содержании IL-17А зафиксированы у детей с гомозиготными генотипами, а при наличии генотипов GG и GA у здоровых детей носило характер тенденции. В группе детей с бронхиальной астмой определены высокие и вариативные показатели содержания IL-17F в сыворотке крови при генотипах СС и CT, у здоровых сверстников только при генотипе CC. Медиана и квартили уровня IL-17F в сыворотке крови у детей с генотипом ТТ в обеих группах практически не различались.
Исследование взаимосвязи генотипа интерлейкинов и содержания общего и специфического IgE выявило корреляции между показателями по полиморфизму T-330G IL-2. У детей с астмой выявлено значимое влияние генотипа IL-2 по полиморфизму T-330G и уровня общего IgE (p < 0,003) и эффекта их парного взаимодействия (p < 0,001). В исследуемых группах наиболее высокие показатели общего IgE в сыворотке крови отмечались у детей с генотипом GG, с максимальной вариацией при генотипе ТG. У здоровых детей с разными генотипами IL-2 по полиморфизму T-330G значимых отличий в уровнях IgE не обнаружено. Наиболее высокие значения медианы специфического IgE зафиксированы у детей с бронхиальной астмой с генотипом GG по полиморфизму T-330G IL-2, при высокой вариабельности значений иммуноглобулина при всех генотипах. Проведенное исследование структуры и встречаемости полиморфизмов промоторной части генов IL-2, IL-4, IL-6, IL-10, IL-17А, IL-17F показало наличие и значимость корреляционной зависимости аллельных вариантов генов и продукции соответствующих интерлейкинов и IgE.
Анализ встречаемости генетических полиморфизмов генов исследуемых цитокинов у детей с различными фенотипами бронхиальной астмы выявил достоверные различия по генотипам практически всех исследуемых интерлейкинов.
При анализе встречаемости и структуры полиморфизма T-330G IL-2 у детей с фенотипом ВБА и фенотипом АБА чаще определяется гомозиготный генотип GG. Среди детей с аллергическим фенотипом гомозиготный генотип GG выявлен в 50,67% случаев, при вирус-индуцированном варианте – в 45,33% случаев, а среди здоровых детей – только в 16% случаев, что повышает риски развития и реализации вирус-индуцированного фенотипа болезни с OR = 3,73 CI 95% (2,37–5,87) при χ² = 33,82; р < 0,001. В группе детей с ВБА при исследовании генотипа IL-4 589C/T частота встречаемости гомозиготного аллеля IL-4 (T874T) составила 30,67% и значительно превышала распространенность у здоровых сверстников (5,00%), гетерозиготного генотипа в 53,33 и 20,00% соответственно. Носительство функционального неблагоприятного аллеля Т полиморфизма T874T гена IL-4 сочеталось с возрастанием риска развития вирус-индуцированного фенотипа болезни (χ² = 56,97; р = 0,001; OR =19,30 (11,23–33,31) CI 95%). Среди детей при АБА носительство мутантного аллеля встречалось реже, чем у детей при вирус опосредованном фенотипе болезни, но значимо чаще, чем в группе здоровых сверстников, увеличивая риск развития болезни.
У детей с ВБА встречаемость мутантного генотипа G174G гена IL-6 выше, чем у здоровых сверстников (20,00% против 7,00% соответственно), коэффициент OR = 1,49 при χ² = 3,35; р = 0,224 CI 95% (0,96–2,29). Гетерозиготный аллель G174С в этой группе детей определен в 53,00% случаев, а у детей с АБА носительство данного аллеля и гомозиготного G174G определялось чаще с высоким коэффициентом OR (табл.).
Таблица
Структура и встречаемость полиморфизма гена интерлейкина 6
у детей при разных фенотипах бронхиальной астмы
Структура полиморфизма интерлейкина | Характеристика генотипа | Контингент | ||
Дети с АБА | Контрольная группа | Дети с ВБА | ||
IL-6 174 G/C | CC | 7 (9,33%) | 33 (33,00%) | 20 (27,00%) |
CG | 44 (58,67%) | 60 (60,00%) | 40 (53,00%) | |
GG | 24 (32,00%) | 7 (7,00%) | 15 (20,00%) | |
Частота встречаемости аллеля | C | 58 (38,67,00%) | 126 (63,00%) | 80 (53,00%) |
G | 92 (61,33%) | 74 (37,00%) | 70 (47,00%) | |
OR (CI 95%) | 2,71 (1,73–4,18) | 1,49 (0,96–2,29) | ||
Критерий χ² | 20,34; р < 0,001 | 3,35; р < 0,05 | ||
Примечание: OR – коэффициент отношения шансов;
CI – доверительный интервал;
АБА – аллерген-индуцированная бронхиальная астма;
ВБА – вирус-индуцированная бронхиальная астма.
У детей с реализацией разных фенотипов бронхиальной астмы в отличие от здоровых сверстников чаще встречались гомозиготный генотип АА IL-10/592 С/А и гетерозиготные генотипы СТ IL-10/819С/Т и GА IL-10/1082 G/А, в то время как среди здоровых сверстников преобладали гомозиготные генотипы СС, СС и GG соответственно. У детей с АБА носительство мутантных аллелей IL-10 A592A и А1082А встречалось чаще, чем у детей с вирус опосредованным фенотипом болезни, что определяло OR (CI 95%) 3,10 (1,99–4,81) и 2,49 (1,61–3,86) соответственно при χ², равном 26,01; р < 0,001 и 17,09; р < 0,01 соответственно в первом случае и OR (CI 95%) 3,34 (2,14–5,20) и 2,64 (1,69–4,12) соответственно при χ² = 32,14; р < 0,001 и 18,91; р < 0,01 во втором случае. Наличие однонуклеотидных замен данных полиморфизмов статистически достоверно увеличивает риск развития аллерген-индуцированного фенотипа бронхиальной астмы в 3,10 раза при носительстве A592A, в 1,50 раза при Т819Т и в 3,34 раза А1082А. Анализ гетерозиготных генотипов С592А, С819T и G1082А IL-10 выявил, что у детей с ВБА частота встречаемости выше, чем при АБА, и составила для вирус-индуцированого фенотипа С592А 62,70% против 38,70%, для С819T 77,30% против 73,40% и для G1082А 73,30% против 42,70% соответственно.
Различия встречаемости генотипов IL-10 у здоровых детей и детей с реализацией различных фенотипов бронхиальной астмы проиллюстрировал преобладающе высокий удельный вес в группе здоровых сверстников гомозиготных генотипов С592С, С819С, G1082G. Эти последние можно охарактеризовать как протективные, а наличие мутантных генотипов А592А и А1082А как предикторы, отражающие высокий риск развития бронхиальной астмы.
В структуре и встречаемости однонуклеотидных полиморфизмов IL-17A (G-197A) у детей с АБА выявлен высокий удельный вес генотипа АА 40,00%, единичная встречаемость аллеля GG при доверительном интервале коэффициента отношения шансов от 0,32 до 0,71. У детей с реализацией ВБА наличие мутантного аллеля A зафиксировано у 26,70% при коэффициенте отношения шансов 0,27 и показателе χ², равном 12,02 (р = 0,39), с доверительным интервалом (0,19–0,37).
Исследование однонуклеотидных полиморфизмов в гене IL-10 (G-1082A, C-819T, С-592A) среди детей с бронхиальной астмой выявило протективный эффект при наличии генотипа GG в положении 1082, генотипа ТТ в 819 и СС в положении 592. Генотип АА IL-10 G-1082A в группе у детей с БА имел наибольшую распространённость и высокий риск развития болезни. Высокие цифры содержания IL-17A в сыворотке крови детей определялись при наличии генотипа АА, а IL-17F при гомозиготном генотипе TT. Шансы относительного риска развития АБА у детей с генотипами IL-17А(G-197A) АА и IL-17F(T-7488C) CC статистически значимо выше, чем у детей с другими генотипами, а при наличии генотипов GG (IL-17А(G-197A)) и TT (IL-17F(T-7488C)) по критерию χ² Пирсона статистически значимо ниже, чем у детей с другими генотипами. Как известно, бронхиальная астма – гетерогенное заболевание с мультифакториальным сложным патогенетическим механизмом [16][17]. Поиск генетических маркеров, контролирующих иммунные патогенетические механизмы различных фенотипов бронхиальной астмы, связан с ассоциаций полиморфных локусов генов-кандидатов с развитием и тяжестью течения аллергических заболеваний. Аллергическая бронхиальная астма представляет один из наиболее распространенных фенотипов, формирующийся вследствие механизмов Т2-воспаления [17–20].
Патогенез БА инициируется сверхэкспрессией интерлейкинов и хемокинов, включая IL-4, IL-5, IL-13, CCL17 и CCL18, и продукцию Ig E [21]. Молекулы IL-4 играют важную роль в дифференцировке Th2- и B-клеток. Они стимулируют созревание избирательных клонов B-лимфоцитов и выработку антигенспецифического IgE. Секвенирование РНК при БА с ранним началом продемонстрировало нарушение регуляции маркеров, связанных с Th2 и Th22/Th17, включая значительный уровень IL-4 [22–25].
Оценка роли генотипов и продукции интерлейкинов в аллергическом воспалении и патофизиологии астмы является важным диагностическим шагом в изучении заболевания. Биомаркеры Т2-воспаления важны при определении фенотипа и прогноза бронхиальной астмы [25][26].
Исследование генов, контролирующих активность интерлейкинов, важны для выявления предрасположенности к бронхиальной астме, раскрытии ее основных патогенетических звеньев и фенотипических вариантов. Характеристика новых биомаркеров и выявление фенотипических подгруппы пациентов с различными генетически опосредованными иммунологическими профилями может способствовать разработке персонализированных стратегий лечения для модификации заболевания и целенаправленной профилактики [27].
Однонуклеотидные полиморфизмы на хромосоме 17q12–21 связаны с генетическим риском развития астмы у детей и ассоциированным с риновирусом свистящим дыханием при последующей инициации астмы. В исследовании отмечено, что генотип-специфичный риск развития астмы присутствовал только у детей, у которых эпизоды свистящего дыхания возникали из-за риновирусной инфекции [28]. У новорожденных, инфицированных респираторными вирусами, наблюдаются снижение синтеза интерферона и активация путей Th2 и Th17, что коррелирует с рецидивирующими хрипами в последующие два года жизни [29].
Интересно отметить, что носители аллелей риска 17q21, выросшие в фермерских или сельских условиях, также оказываются более защищенными от развития астмы. Риски возникновения бронхиальной астмы снижаются за счет восстановления активации Th1/Th2/Th17 после микробной стимуляции [30][31]. Таким образом, воздействие окружающей среды в раннем возрасте может снизить риск раннего дебюта астмы, обусловленного генетическими вариантами, тем самым предоставляя возможности для стратегий профилактики.
G. Wang и др. [32] посредством протеомного анализа идентифицировали IL-6 и CXCL10 как потенциальные биомаркеры нарушения развития функции легких. В исследованиях городской среды и детской астмы, проведенных L.B. Bacharier и др. [33]с помощью алгоритма кластеризации, определено пять фенотипов, различающихся по характеру хрипов и развитию сенсибилизации к аэроаллергенам.
Проведенный анализ генетической вариации генов цитокинов выявил ассоциативные связи между вариантами генотипов и синтезом цитокинов. Информативность определения однонуклеотидных полиморфизмов генов цитокинов позволяет рассматривать их как дополнительный диагностический предиктор риска развития и реализации определенного фенотипа аллергического заболевания у детей. Взаимосвязь продукции IL-4, IL-6, IL-10, IL-17А, IL-17F и IgE с полиморфными вариантами промоторных регионов генов свидетельствует о генетической детерминированности уровня синтеза интерлейкинов и иммуноглобулина.
Заключение
Генетические факторы во многом определяют риски развития и эффективность персонифицированной терапии разных фенотипов бронхиальной астмы у детей. Перспективным направлением является изучение ассоциаций полиморфных локусов генов-кандидатов с развитием и тяжестью течения аллергических заболеваний. Полиморфизм единичных нуклеотидов считается наиболее частым изменением структуры генов, при котором какой-либо генетический признак в организме существует в нескольких формах, что приводит к сосуществованию более одного морфологического типа в одной популяции.
Ассоциации содержания с аллельными вариантами промоторных регионов генов интерлейкинов свидетельствует о генетической детерминированности их продукции. Полученные данные подтверждают, что нуклеотидные полиморфизмы, локализованные в промоторах регуляторных участков генов цитокинов, способствуют их влиянию на транскрипционную активность генов, тем самым изменяя уровень соответствующих интерлейкинов. Исследования полиморфизмов генов, особенностей продукции и содержания интерлейкинов Th1/ Th 2/ Th 17 при бронхиальной астме показывают различия в структуре и встречаемости мутантных аллелей. Они вызывают аберрантную продукцию интерлейкинов, вариативность риска развития и реализацию определенного фенотипа заболевания. Носительство мутантных аллелей IL-4 (T-589T) можно характеризовать как генетические предикторы реализации вирус-индуцированного фенотипа, а при наличии мутантных аллелей IL-2 (G-330G), IL-6 (G-174G), IL-17А (А-197А), IL-10 (А-592A), IL-10 (Т-819Т) и IL-10 (А-1082А) выше коэффициент отношения шансов для аллерген-индуцированного фенотипа бронхиальной астмы.
Конфликт интересов: авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Источник финансирования: научное исследование выполнено при финансовой поддержке гранта в рамках реализации программы стратегического академического лидерства «Приоритет-2030».
Участие авторов:
Концепция и дизайн исследования – ВБШ, ЕВП
Сбор и обработка материала – МСД, АИТ, ВКК, ВАС
Статистическая обработка – МСД, ВАС
Написание текста – ВБШ, ЕВП, МСД, ВАС
Редактирование – ВБШ, ЕВП, МСД, ВАС
Список литературы
1. Agache I, Shamji MH, Kermani NZ, Vecchi G, Favaro A, Layhadi JA, Heider A, Akbas DS, Filipaviciute P, Wu LYD, Cojanu C, Laculiceanu A, Akdis CA, Adcock IM. Multidimensional endotyping using nasal proteomics predicts molecular phenotypes in the asthmatic airways. J Allergy Clin Immunol. 2023;151(1):128– 37. doi: 10.1016/j.jaci.2022.06.028
2. Lötvall J, Akdis CA, Bacharier LB, Bjermer L, Casale TB, Custo vic A, Lemanske RF Jr, Wardlaw AJ, Wenzel SE, Greenberger PA. Asthma endotypes: a new approach to classification of disease entities within the asthma syndrome. J Allergy Clin Immunol. 2011; 127(2): 355–60. doi: 10.1016/j.jaci.2010.11.037
3. Ozdemir C, Kucuksezer UC, Akdis M, Akdis CA. The concepts of asthma endotypes and phenotypes to guide current and novel treatment strategies. Expert Rev Respir Med. 2018;12(9):733–43. doi:10.1080/17476348.2018.1505507
4. Agache I, Akdis CA. Endotypes of allergic diseases and asthma: an important step in building blocks for the future of precision medicine. Allergol Int. 2016;65(3):243–52. doi: 10.1016/j.alit.2016.04.011
5. Kappen J, Diamant Z, Agache I, Bonini M, Bousquet J, Canonica GW, Durham SR, Guibas GV, Hamelmann E, Jutel M, Papadopoulos NG, Roberts G, Shamji MH, Zieglmayer P, Gerth van Wijk R, Pfaar O. Standardization of clinical outcomes used in allergen immunotherapy in allergic asthma: An EAACI position paper. Allergy. 2023;78:2835–50. doi: 10.1111/all.15817
6. Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention, 2023. URL: http://www.ginasthma.org (Accessed March 5, 2024).
7. Xing Y, Leung AY, Wong GK. From preschool wheezing to asthma: Environmental determinants. Pediatr Allergy Immunol. 2023;34:e14049. doi: 10.1111/pai.14049
8. Han Y, Jia Q, Jahani PS, Hurrell BP, Pan C, Huang P, Gukasyan J, Woodward NC, Eskin E, Gilliland FD, Akbari O, Hartiala JA, Allayee H. Genome-wide analysis highlights contribution of immune system pathways to the genetic architecture of asthma. Nat Commun. 2020;11(1):1776. doi: 10.1038/s41467-020-15649-3
9. Kabesch M, Tost J. Recent findings in the genetics and epigenetics of asthma and allergy. Semin Immunopathol. 2020; 42(1):43–60.
10. Agache I, Akdis CA. Precision medicine and phenotypes, endotypes, genotypes, regiotypes, and theratypes of allergic diseases. J Clin Invest. 2019; 129(4): 1493–503. doi: 10.1172/JCI124611
11. Agache I, Akdis C, Jutel M, Virchow JC. Untangling asthma phenotypes and endotypes. Allergy. 2012; 67(7): 835–46. doi: 10.1111/j.1398-995.2012.02832.x
12. Dyjack N, Goleva E, Rios C, Kim BE, Bin L, Taylor P, Bronchick C, Hall CF, Richers BN, Seibold MA, Leung DYM. Minimally invasive skin tape strip RNA sequencing identifies novel characteristics of the type 2-high atopic dermatitis disease endotype. J Allergy Clin Immunol. 2018; 141(4): 1298–309. doi: 10.1016/j.jaci.2017.10.046
13. Shamji MH, Layhadi JA, Sharif H, Penagos M, Durham SR. Immunological responses and biomarkers for allergen-specific immunotherapy against inhaled allergens. J Allergy Clin Immunol Pract. 2021;9(5):1769–78. doi: 10.1016/j.jaip.2021.03.029
14. Guideline on the Clinical Development of Products for Specific Immunotherapy for the Treatment of Allergic Diseases. CHMP; 2008.
15. Biomarkers and surrogate endpoints: preferred definitions and conceptual framework. Clin Pharmacol Ther. 2001;69(3):89–95. doi: 10.1067/mcp.2001.113989
16. Burney P, Jarvis D, Perez-Padilla R. The global burden of chronic respiratory disease in adults. Int J Tuberc Lung Dis. 2015;19(1):10–20. doi: 10.5588/ijtld.14.0446
17. Israel E, Reddel HK. Severe and difficult-to-treat asthma in adults. N Engl J med. 2017;377(10):965–76. doi: 10.1056/NEJMra1608969
18. Haldar P, Pavord ID, Shaw DE, Berry MA, Thomas M, Brightling CE, Wardlaw AJ, Green RH. Cluster analysis and clinical asthma phenotypes. Am J Respir Crit Care Med. 2008;178(3):218–24. doi: 10.1164/rccm.200711-1754OC
19. Holgate ST, Wenzel S, Postma DS, Weiss ST, Renz H, Sly PD. Asthma. Nat Rev Dis Primers. 2015;1:15025. doi: 10.1038/nrdp.2015.25
20. Del Giacco SR, Bakirtas A, Bel E, Custovic A, Diamant Z, Hamelmann E, Heffler E, Kalayci Ö, Saglani S, Sergejeva S, Seys S, Simpson A, Bjermer L. Allergy in severe asthma. Allergy. 2017;72(2):207–20. doi: 10.1111/all.13072
21. Wynn TA. Type 2 cytokines: mechanisms and therapeutic strategies. Nat Rev Immunol. 2015;15(5):271–82. doi:10.1038/nri3831
22. Junttila IS. Tuning the cytokine responses: an update on interleukin (IL)-4 and IL-13 receptor complexes. Front Immunol. 2018;9:888. doi: 10.3389/fimmu.2018.00888
23. Zhou X, Hu H, Balzar S, Trudeau JB, Wenzel SE. MAPK regulation of IL-4/IL-13 receptors contributes to the synergistic increase in CCL11/eotaxin-1 in response to TGF-beta1 and IL-13 in human airway fibroblasts. J Immunol. 2012;188(12):6046–54. doi: 10.4049/jimmunol.1102760
24. Oetjen LK, Mack MR, Feng J, Whelan TM, et al. Sensory neurons co-opt classical immune signaling pathways to mediate chronic itch. Cell. 2017;171(1):217–28. e213. doi: 10.1016/j.cell.2017.08.006
25. Renert-Yuval Y, Del Duca E, Pavel AB, Fang M, et al. The molecular features of normal and atopic dermatitis skin in infants, children, adolescents, and adults. J Allergy Clin Immunol. 2021;148(1):148–63. doi: 10.1016/j.jaci.2021.01.001
26. Kappen J, Diamant Z, Agache I, Bonini M, et al. Standardization of clinical outcomes used in allergen immunotherapy in allergic asthma: An EAACI position paper. Allergy. 2023;78:2835–50. doi: 10.1111/all.15817
27. Shamji MH, Ollert M, Adcock IM, Bennett O, et al. EAACI guidelines on environmental science in allergic diseases and asthma–leveraging artificial intelligence and machine learning to develop a causality model in exposomics. Allergy. 2023; 78: 1742–57. doi: 10.1111/all.15667
28. Caliskan M, Bochkov YA, Kreiner-Moller E, Bonnelykke K, et al. Rhinovirus wheezing illness and genetic risk of childhood-onset asthma. N Engl J Med. 2013;368(15):1398–407. doi: 10.1056/NEJMoa1211592
29. Turi KN, Shankar J, Anderson LJ, Rajan D, et al. Infant viral respiratory infection nasal immune-response patterns and their association with subsequent childhood recurrent wheeze. Am J Respir Crit Care Med. 2018;198(8):1064–73. doi: 10.1164/rccm.201711-2348OC
30. Loss GJ, Depner M, Hose AJ, Genuneit J, et al. The early development of wheeze. Environmental determinants and genetic susceptibility at 17q21. Am J Respir Crit Care Med. 2016;193(8):889–97. doi: 10.1164/rccm.201507-1493OC
31. Illi S, Depner M, Pfefferle PI, Renz H, et al. Immune responsiveness to LPS determines risk of childhood wheeze and asthma in 17q21 risk allele carriers. Am J Respir Crit Care Med. 2022;205(6):641–50. doi: 10.1164/rccm.202106-1458OC
32. Wang G, Hallberg J, Faner R, Koefoed HJ, et al. Plasticity of individual lung function states from childhood to adulthood. Am J Respir Crit Care Med. 2023;207(4):406–15. doi: 10.1164/rccm.202203-0444OC
33. Bacharier LB, Beigelman A, Calatroni A, Jackson DJ, et al. Longitudinal phenotypes of respiratory health in a high-risk urban birth cohort. Am J Respir Crit Care Med. 2019;199(1):71–82. doi: 10.1164/rccm.201801-0190OC
Об авторах
В. Б. ШуматовРоссия
Владивосток
Е. В. Просекова
Россия
Просекова Елена Викторовна – д-р мед. наук, профессор, заведующий кафедрой клинической лабораторной диагностики, общей и клинической иммунологии
тел.: +7 (908) 993-09-04
69002, г. Владивосток, пр-т Острякова, 2
М. С. Долгополов
Россия
Владивосток
А. И. Турянская
Россия
Владивосток
В. К. Ковальчук
Россия
Владивосток
В. А. Сабыныч
Россия
Владивосток
Рецензия
Для цитирования:
Шуматов В.Б., Просекова Е.В., Долгополов М.С., Турянская А.И., Ковальчук В.К., Сабыныч В.А. Сравнительная характеристика генотипов интерлейкинов и риски реализации фенотипов бронхиальной астмы у детей. Тихоокеанский медицинский журнал. 2024;(1):5-10. https://doi.org/10.34215/1609-1175-2024-1-5-10
For citation:
Shumatov V.B., Prosekova E.V., Dolgopolov M.S., Turyanskaya A.I., Kovalchuk V.K., Sabynych V.A. Comparative characterization of interleukin genotypes and risks of bronchial asthma phenotypes in children. Pacific Medical Journal. 2024;(1):5-10. (In Russ.) https://doi.org/10.34215/1609-1175-2024-1-5-10





































