Перейти к:
Клинико-эпидемиологические аспекты геморрагической лихорадки с почечным синдромом в Приморском крае
https://doi.org/10.34215/1609-1175-2024-4-76-81
Аннотация
Цель: оценка эпизоотической и клинико-эпидемиологической ситуации по заболеваемости геморрагической лихорадкой с почечным синдромом (ГЛПС) в Приморском крае в период 2019–2023 гг.
Материалы и методы. Ретроспективный клинико-эпидемиологический анализ заболеваемости ГЛПС проведен у 149 пациентов, эпизоотический процесс в популяциях мелких млекопитающих в природных и синантропных очагах изучен согласно общепринятым методикам.
Результаты. Активность природных очагов ГЛПС, обусловленных циркуляцией 3 ортохантавирусов (Hantaan и его генотип Amur, Seoul) сохраняется, причем за счет доминирования носителя Amur в организме восточноазиатской мыши, несмотря на четкую тенденцию снижения заболеваемости (с 4,9 показателя среднего многолетнего уровня до 1,6 на 100 тысяч населения в 2019 г.). Отмечено преобладание тяжелых и осложненных форм инфекции (23,5 %), высокая летальность (до 11,5 % в 2023 г.). Выявлены некоторые клинико-патогенетические прогностические критерии тяжести ГЛПС в ранние сроки болезни.
Заключение. Тяжесть течения, трудности первичной диагностики определяет ГЛПС как актуальную инфекцию здравоохранения региона.
Ключевые слова
Для цитирования:
Иванис В.А., Иунихина О.В., Попов А.Ф., Хомичук Т.Ф., Захарова Г.А., Компанец Г.Г., Верхотурова В.И., Перевертень Л.Ю., Кушнарева Т.В., Щелканов М.Ю. Клинико-эпидемиологические аспекты геморрагической лихорадки с почечным синдромом в Приморском крае. Тихоокеанский медицинский журнал. 2024;(4):76-81. https://doi.org/10.34215/1609-1175-2024-4-76-81
For citation:
Ivanis V.A., Iunikhina O.V., Popov A.F., Khomichuk T.F., Zacharova G.A., Kompanets G.G., Verkhoturova V.I., Pereverten L.Yu., Kushnareva T.V., Shchelkanov M.Yu. Clinical and epidemiological aspects of hemorrhagic fever with renal syndrome in the Primorsky Krai. Pacific Medical Journal. 2024;(4):76-81. (In Russ.) https://doi.org/10.34215/1609-1175-2024-4-76-81
Геморрагическая лихорадка с почечным синдромом (ГЛПС) является нозоформой острой природно-очаговой хантавирусной инфекции, постоянно регистрируемой на Евроазиатском континенте [1][2]. Вторая нозоформа, хантавирусный кардиолегочный синдром (ХКЛС), регистрируется только в странах Северной и Латинской Америки [3]. В России в разные годы ГЛПС занимает лидирующее место среди всех природно-очаговых инфекций [3], с устойчивой тенденцией к снижению заболеваемости в последнее десятилетие (4,9 на 100 тыс. населения).
Возбудителями ГЛПС являются Orthohantavirus puumalaense и Orthohantavirus dobravaense в евро-пейской части России, носителями которых являются рыжая полевка и кавказская лесная мышь [4][5]. На территории Приморского края Orthohantavirus haantanense (дальневосточный вариант вируса Hantaan и его генотип Amur), природными хозяевами которых являются мыши рода Apodemus (восточный подвид полевой и восточноазиатской мыши) и Orthohantavirus seoulense в популяции серой крысы [6][7]. Многолетний клинико-эпидемиологический мониторинг, географическое положение региона, граничащего с Китаем, мировым лидером по заболеваемости, определяет ГЛПС в Приморском крае как актуальную, весьма значимую для практического здравоохранения инфекцию. Особое значение распространение ГЛПС обретает с учетом ее принадлежности к непредсказуемым заболеваниям, частоты тяжелых форм, высокой летальности и трудности клинической диагностики.
Целью работы является оценка эпизоотической ситуации и клинико-эпидемиологический анализ заболеваемости ГЛПС в Приморском крае за последние в период 2019–2023 гг. в зависимости от характера эпидемического очага, генотипа ортохантавируса, клинико-патогенетических проявлений инфекции, особенно в ранние фазы болезни.
Материалы и методы исследования
Ретроспективный клинико-эпидемиологический анализ проведен у 149 пациентов ГЛПС, находившихся в инфекционных стационарах Приморского края за последние 5 лет. У всех пациентов диагноз подтвержден серологически (непрямой иммунофлуоресцентный анализ с коммерческой тест-системой «Диагностикум ГЛПС, поливалентный», ФГБНУ, г. Москва) и/или иммуноферментным методом обнаружения специфических антител коммерческих наборов ВектоХанта IgM и ВектоХантаIgG (ЗАО «Вектор-Бест», п. Кольцово). Косвенное определение генотипа ортохантавируса считали возможным путем подробного изучения эпидемиологии, районирования предполагаемого места заражения, клинической картины каждого случая заболевания ГЛПС.
Для изучения эпизоотического процесса в популяциях мелких млекопитающих (ММ) использовали следующие показатели: численность и инфицированность на 100 ловушко/ночей (л/н) согласно общепринятой методике. Инфицированность ММ определяли по наличию антигена ортохантавируса в легких и/или специфических антител в крови. Для обнаружения специфического антигена в 10% суспензии легких в иммуноферментном анализе (ИФА) использовали коммерческую тест-систему «Хантагност».
Статистический анализ медицинских данных проводили с использованием программы Microsoft Excel с вычислением процентного соотношения критериев оценки.
Результаты исследования
За анализируемый период (2019–2023 гг.) в При-морском крае отмечено значительное снижение уровня заболеваемости ГЛПС: с 2,6 в 2019 году до 1,6 тыс. населения в 2023 году, причем тренд снижения соответствует таковому в России (рис.). Заболеваемость регистрировалась на большинстве территорий: сельский эпидочаг с циркуляцией Hantaan и его геноварианта Amur (97 пациентов) и городской эпидочаг с преимущественной циркуляцией Seoul (52 пациента), хотя такое деление эпидемиологически условно, так как в поселках и пригородах края давно сформирован смешанный очаг трех ортохантовирусов [2].
При сопоставлении уровней заболеваемости в исследуемый период и результатов эпизоотических исследований в природных очагах инфекции отмечен подъем эпидемического процесса в популяциях полевой и восточноазиатской мыши. В 2019 году заболеваемость ГЛПС оставалась на среднемноголетнем уровне (2,7 на 100 тыс. населения), но характеризовалась подъемом эпизоотического процесса в популяциях как полевой, так и восточноазиатской мышей (численность 22,6, инфицированность 0,7 на 100 л/н). Причем при распределении случаев ГЛПС в отдельных районах края (Тернейский, Кавалеровский, Лазовский) заболеваемость была повышенной (соответственно 9,0; 8,4; 7,7 на 100 тыс. населения). В 2020–2021 годах общая заболеваемость ГЛПС резко снизилась (1,53–0,7), но при напряженной эпидситуации в Хорольском районе (22,5), хотя эпизоотический процесс в популяции полевой мыши достиг пика с мозаичным включением новых территорий (численность 15,0–19,0 и инфицированность 2,5–4,0 на 100 л/н в Спасском и Ханкайском районах). Продолжающийся подъем инфицированности восточноазиатской мыши (численность и инфицированность 26,6 и 6,7 на 100 л/н) определил высокую заболеваемость в Пожарском и Кавалеровском районах (26,0 и 8,5 на 100 тыс. населения), что характерно для этой популяции [8][9]. В 2022–2023 общекраевая заболеваемость выросла более чем в два раза на 14 территориях. Во Владивостоке заболеваемость оставалась стабильной, соответствуя среднемноголетней численности серой крысы (численность 10,0; инфицированность 4,5 на 100 л/н.).
Средний возраст заболевших ГЛПС составил 39,9 ± 3,1 года, традиционно преобладали мужчины 107 (74,8%). Социальная структура заболевших мало отличалась от таковой в предыдущие годы [9]: сельскохозяйственные и лесные работники, охотники, туристы, сборщики дикоросов. В городском очаге преобладали работники складов, магазинов, мастерских, гаражей. Вся заболеваемость за анализируемый период была спорадическая, вспышек не наблюдалось. Групповая заболеваемость в 2021–2022 гг. составила 9 жителей с. Красный Яр на территории Национального парка «Бикин». Статистика заболеваемости ГЛПС последних лет показывает абсолютное доминирование среднетяжелых (74,5%) и тяжелых (23,5%) форм инфекции (табл. 1), причем сельский очаг традиционно характеризовался более тяжелыми формами (27,8%), чем городской [10]. Легкие формы, склонные к спонтанному выздоровлению, регистрировались редко (2,01%). Приморский край традиционно отличался высокой летальностью в разные годы (3,2–9,5%), в 2023 году – 11,5%, причем у одного пациента диагноз ГЛПС был установлен и подтвержден на аутопсии. В 2021 году умерших не зарегистрировано, что, возможно, связано с пандемией новой коронавирусной инфекции, характеризующейся тяжелым течением, сходством патогенеза и клинико-морфологического комплекса патологии, вероятностью неправильного статистического учета этих инфекций.
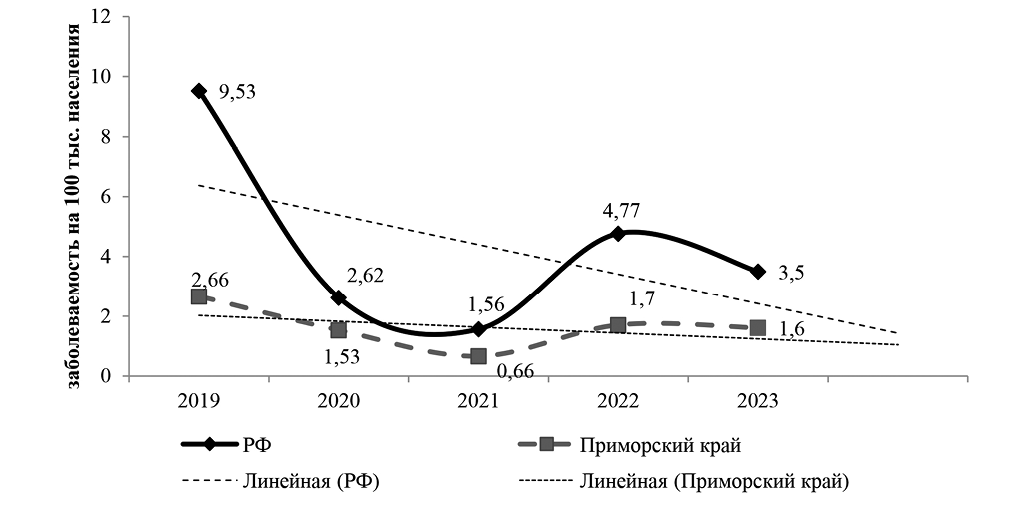
Рис. Динамика заболеваемости ГЛПС в Приморском крае (2019–2023 гг.).
Таблица 1
Характеристика клинических форм по тяжести и принадлежности к эпидемиологическому типу очага
Форма тяжести | Кол-во больных | Сельский эпид. очаг | Городской эпид. очаг | |||
абс. | % | абс. | % | абс. | % | |
Легкая | 3 | 2,0 | 0 | 0 | 3 | 5,7 |
Среднетяжелая | 111 | 74,5 | 70 | 72,1 | 41 | 78,84 |
Тяжелая | 35 | 23,5 | 27 | 27,8 | 8 | 15,4 |
ВСЕГО | 149 | 100 | 97 | 65,1 | 59 | 34,9 |
Обсуждение полученных данных
Эпидемиологические аспекты. Низкий уровень заболеваемости обычно связан со снижением популяционной численности и инфицированности грызунов – носителей ортохантавирусов, кинетикой хронической эндогенной инфекции, что обуславливает низкую эпизоотическую активность природных очагов [11]. Исследуемый пятилетний период отличался продолжительным подъемом эпизоотической активности восточноазиатской мыши – природного носителя генотипа Amur ортохантавируса Hantaan. В активной стадии отмечался рост доли зверьков с антигеном в легких и других органах, экскретирующих вирус во внешнюю среду, а также присутствие у значительной части грызунов антител низкой авидности, что отражает факт недавнего инфицирования. В городских очагах наиболее опасным с эпидемической точки зрения остается проживание на нижних этажах многоэтажных домов (23% случаев заражения с обнаружением РНК ортохантавируса получено в пробах воздуха, что четко подтверждает воздушно-пылевой (аэрозольный) путь заражения человека. При инфицировании имеет значение степень загрязнения экскрементами и мочой инфицированных грызунов, длительность пребывания там человека [11]. Эти факторы тесно связаны с развитием манифестного течения ГЛПС и являются эпидемиологическими критериями тяжести инфекции. Реальной причиной снижения заболеваемости за последние годы являются и дефекты выявления инфекции. К ним относятся ошибочная клиническая диагностика, отсутствие специфического лабораторного тестирования при жизни пациента и трупного материала, недостаточное обследование эпидочагов.
Клинические аспекты. Полиморфизм клинической симптоматики обуславливает трудность ранней диагностики болезни. Диагноз ГЛПС первоначально установлен у 76,5% пациентов. Клиническая картина у 149 пациентов отражала классический вариант течения болезни: острое начало с манифестацией общетоксического синдрома: лихорадка, головная боль, миалгии, артралгии, общий дискомфорт в самочувствии, связанных с виремией и системной продукцией провоспалительных цитокинов сосудистым эндотелием. Известно, что ортохантавирус не обладает цитолитическим эффектом, реплицируясь в эндотелии микроциркуляторного русла органов-мишенях (легкие, почки, печень) без повреждения, вызывая острое иммунное воспаление, реализация которого определяется агрессивностью клеток-эффекторов иммунного ответа макроорганизма [12]. Морфологический маркер иммунного воспаления при ГЛПC – резкое повышение сосудистой проницаемости, преобладание экссудативных тканевых процессов, инициация геморрагических и ишемических некрозов [13]. Полифункциональность эндотелия обуславливает раннее развитие синдрома гемодинамических микроциркуляторных расстройств (гипотония, обмороки, менингизм, нарушение зрения, характерная гиперемия и одутловатость кожи лица). Кардинальный синдром ГЛПС – острая почечная недостаточность (ОПН) развивается в конце первой недели заболевания. В этот период возникают жажда, рвота, болевой синдром в животе и поясничной области, олигурия, типичные изменения в урограмме: макрогематурия, протеинурия, цилиндрурия, быстрое нарастание азотемии, отек паренхимы на УЗИ почек (синдром «выделенных пирамидок») отмечалась также у большинства пациентов (59,7%) Параллельно с ОПН нарастает геморрагический (ДВС) синдром, проявляющийся петехиальной линейной сыпью и экхимозами на коже, слизистых (у 49 пациентов – 32,8%). Тромбоцитопения является патогномоничным симптомом ГЛПС, маркером ранней фазы даже при легких формах инфекции [14]. Оценка значимости критериев тяжести заболевания определялась не только совокупностью ключевых клинико-патогенетических синдромов, но и ранними сроками их появления, быстрыми темпами их нарастания (табл. 2). Замечено, что при адекватной терапии регресс клинико-лабораторных признаков ОПН довольно быстрый (3–4 дня), что можно считать прогностическим критерием выздоровления.
Таблица 2
Ранние (5–8 дней) прогностические клинико-лабораторные критерии тяжести (абс/%) у больных ГЛПС (n = 149)
Высокая продолжительная (≥ 7 дней) лихорадка | 35/ 23,5 |
Повторная рвота с постоянными позывами, анорексия | 20/ 13,4 |
Интенсивные боли в животе, в поясничной области | 29/ 19,5 |
Неврологические проявления: резкая головная боль, менингизм, двигательное беспокойство, энцефалопатия | 35/ 23,5 |
Стойкая гипотензия (АД ≤ 90/50 мм рт. ст.), обмороки | 29/ 19,5 |
Инфекционно-токсический шок | 18/ 12,1 |
Выраженный геморрагический синдром: петехии и экхимозы, макрогематурия, носовые и желудочно-кишечные кровотечения | 48/ 32,2 |
Выраженная гипокоагуляция в гемостазиограмме (димер – 10–100 норм, фибриноген 3–5 норм, РФМК 2–3 нормы) | 35/ 23,5 |
Выраженные признаки ОПН (диурез ≤ 500,0 мл): жажда, «сухой» язык, пастозность лица, олигурия, анурия, икота | 35/ 23,5 |
Гиперлейкоцитоз ≥ 20,0 × 109/л | 29/ 19,5 |
Гемоконцентрация (гемоглобин ≥ 150 г/л) | 75/ 50,3 |
Цитолиз 2–4 нормы АСТ и АЛТ | 35/ 23,5 |
Диарея (19 пациентов – 12,7%) и цитолиз (2–3 нормы) в ранний период также отражали тяжесть инфекции. Пульмонарный синдром, свойственный больше ХКЛС, наблюдается и при ГЛПС и расценивается как критерий тяжести течения [15]. Рентгенологические признаки ОРДС I-II степени отмечены у 11 пациентов тяжелыми формами, двусторонняя пневмония и отек легких при аутопсии у 5 умерших больных. Непосредственными причинами смерти у 11 человек в ранние сроки болезни (5–6 дни) был инфекционно-токсический шок (4 пациента), разрывы капсулы почки и массивные желудочно-кишечные кровотечения (2 пациента). У остальных пациентов, умерших в более поздние сроки заболевания (9–16 дни), наблюдалась полиорганная недостаточность с прогрессированием ОПН и ДВС-синдрома.
Лечение ГЛПС до настоящего времени является нерешенной проблемой. Этиотропная терапия рибавирином, особенно при приеме внутрь, малоэффективна и плохо переносится пациентами, больные легкими и среднетяжелыми формами в ней не нуждаются. Стандартная патогенетическая терапия складывается из парентерального введения гипертонических растворов глюкозы (40, 20%) 100,0–200,0 мл (с расчетной дозой инсулина), хлорида натрия (10%) 20,0–40 мл и бикарбоната натрия (4%) 100–200 мл. Причем объем жидкости, введенной внутрь и парентерально в сутки, не должен превышать потери ее с мочой, рвотой и диареей не более 500 мл. Цель таких инфузий – уменьшение сосудистой проницаемости и гипергидратации тканей. Следует предостеречь от раннего назначения любых антибиотиков, введение кортикостероидов, вазопрессоров должно быть обосновано и кратко-временно. Важно вовремя определить показания к гемодиализу, при этом тромбоцитопения не является противопоказанием к процедуре.
Заключение
Приморский край является регионом активных очагов ГЛПС (природного и синантропного) с циркуляцией 3 ортохантавирусов: Hantaan, его генотипа Amur и Seoul. Традиционное выделение двух эпидемических очагов является нецелесообразным с учетом расширения городских агломераций с включением лесных территорий. Исследуемый пятилетний период оказался продолжительным подъемом эпизоотической активности восточноазиатской мыши – природного носителя генотипа Amur. Клиническое течение инфекции мало отличалось от наблюдений предыдущих лет с высокой долей тяжелых форм и летальности на фоне относительно низких показателей заболеваемости. Выявление ранних диагностических и прогностических критериев, связанных с системным иммунным воспалением, диктует необходимость применения адекватного патогенетического лечения.
Список литературы
1. Савицкая Т.А., Иванова А.В., Зубова А.А. Хантавирусные болезни : обзор эпидемиологической ситуации в мире. Анализ эпидемиологической ситуации по геморрагической лихорадке с почечным синдромом в Российской Федерации в 2023 г. и прогноз на 2024 г. Проблемы особо опасных инфекций. 2024;(1):113–24. doi: 10.21055/0370-1069-2024-1-113-124
2. Tariq M, Kim DM. Hemorrhagic fever with renal syndrome : literature review, epidemiology, clinical picture and pathogenesis. Infection & Chemotherapy. 2022;54(1):1–19. doi: 10.3947/ic2021.0148
3. Avšič-Županc T, Saksida A, Korva M. Hantavirus infections. Clin. Microbiol. Infect. 2019; 21S: e6-e16. doi: 10.1111/1469-0691-12291
4. Ишмухаметов А.А., Дзагурова Т.К., Морозов В.Г. Характеристика хантавирусов – возбудителей зоонозных геморрагических лихорадок. Эпидемиология и вакцинопрофилактика. 2017;16, 3(94): 26–32. doi: 10.31631/2073-3046-2017-16-3-26-32
5. Kabwe E, Davidyuk Y, Shamsutdinov A. Prevalence of the Puumala orthohantavirus strains in the Pre-Kama Area of the Republic of Tatarstan, Russia. Pathogens. 2020;9(9):775 doi: 10.3390/9090775
6. Zhonoxing Wei, Kenta Shimizu, Rakiiy S. Sarii pathological studies on Hantaan vires-infected mice simulating severe. Hemorrhagic fever with renal syndrome. Viruses.2022;14:2247. doi: 10.3392/v14102247
7. Яшина Л.Н., Сметанникова Н.А., Компанец Г.Г. Молекулярная эпидемиология патогенных хантавирусов на Дальнем Востоке России, 2015–2018г.г. Проблемы особо опасных инфекций. 2019;4:102–8. doi: 10.21055/0370-1069-2019-4-102-108
8. Kushnareva TV, Slonova RA. The Natural host range of Hantaviruses and their reservoir potential in the dynamic of the epizootic process within the ecosystems of Primorsky Krai. Contemporary Problems of Ecology. 2014;7(1);19–25.
9. Компанец Г.Г., Иунихина О.В. Современные эпидемиологические аспекты геморрагической лихорадки с почечным синдромом : к 85-летию изучения на Дальнем Востоке России. Тихоокеанский медицинский журнал.2018;3;9–13.
10. Иванис В.А., Кушнарева Т.В., Компанец Г.Г., Верхотурова В.И., Иунихина О.В., Перевертень Л.Ю., Максема И.П. Геморрагическая лихорадка с почечным синдромом на юге Дальнего Востока России: актуальные проблемы диагностики и терапии. Журнал Инфектологии. 2015;7(3);51–8. doi: 10.226251/2027-6732-2015-7-3-51-58
11. Слонова Р.А., Кушнарева Т.В., Иунихина О.В. Динамика выявления хантавируса в органах выделения мышей рода Apodemus и ее связь с эпидемическим проявлением хантавирусной инфекции. Вопросы вирусологии. 2010;2:38–42.
12. Albornoz A, Hoffmann AB, Lozach PY. Early Bunyavirus-Host Cell. Interaction. Viruses. 2016;8(5): pii E143. doi: 10.3390/v8050143
13. Risteska-Nejashmikj V, Ristikj-Stomnaroska D, Borevska G. Facing of family doctor with Hantavirus infection. J. Med. Sci. 2019;7 (10):1660–4. doi: 10.3889/oamjms.2019.468
14. Moore RА., Griffen D. Hantavirus Syndrome. Stat Pearls Publishing LLC [Internet]. Author Information. Last Update: May 10, 2019. https: www.nlm.gov/books/NBK.513243/ PMID: 30020615. (available date/25/05/2024)
15. Dreshaj Sh, Ajazaj L, Hasani NA. Nonfatal case of Dobrava Hantavirus hemorrhagic fever with renal syndrome combined with Hantavirus cardiopulmonary syndrome. J. Glob. Infect. 2018;10(1):22–5. doi: 10.4103/jgid.jgid1217
Об авторах
В. А. ИванисРоссия
Владивосток
О. В. Иунихина
Россия
Владивосток
А. Ф. Попов
Россия
Александр Федорович Попов, профессор
кафедра эпидемиологии и военной эпидемиологии
690002; проспект Острякова, 2; Владивосток
тел.: 8 (914) 704-56-20
Т. Ф. Хомичук
Россия
Владивосток
Г. А. Захарова
Россия
Владивосток
Г. Г. Компанец
Россия
Владивосток
В. И. Верхотурова
Россия
Владивосток
Л. Ю. Перевертень
Россия
Владивосток
Т. В. Кушнарева
Россия
Владивосток
М. Ю. Щелканов
Россия
Владивосток
Рецензия
Для цитирования:
Иванис В.А., Иунихина О.В., Попов А.Ф., Хомичук Т.Ф., Захарова Г.А., Компанец Г.Г., Верхотурова В.И., Перевертень Л.Ю., Кушнарева Т.В., Щелканов М.Ю. Клинико-эпидемиологические аспекты геморрагической лихорадки с почечным синдромом в Приморском крае. Тихоокеанский медицинский журнал. 2024;(4):76-81. https://doi.org/10.34215/1609-1175-2024-4-76-81
For citation:
Ivanis V.A., Iunikhina O.V., Popov A.F., Khomichuk T.F., Zacharova G.A., Kompanets G.G., Verkhoturova V.I., Pereverten L.Yu., Kushnareva T.V., Shchelkanov M.Yu. Clinical and epidemiological aspects of hemorrhagic fever with renal syndrome in the Primorsky Krai. Pacific Medical Journal. 2024;(4):76-81. (In Russ.) https://doi.org/10.34215/1609-1175-2024-4-76-81





































