Перейти к:
Обзор современных разработок в области Х-лучевой фотодинамической терапии
https://doi.org/10.34215/1609-1175-2025-1-5-9
Аннотация
Дополнением к традиционному методу фотодинамической терапии выступает разработка и применение фотосенсибилизаторов, возбуждающихся высокоэнергетическими Х-лучами. Применение таких материалов способно обойти серьезный недостаток фотодинамической терапии – лечение поверхностно расположенных опухолей, доступных для лазера. В обзоре представлены современные достижения относительно способов получения, безопасности и эффективности биодоступных соединений для фотодинамической терапии, индуцированной Х-лучами. Определены потенциал и перспективы будущего применения таких конструкций в клинической практике.
Ключевые слова
Для цитирования:
Шевченко О.В., Шуматов В.Б., Елисеева Е.В., Юрьева К.А., Медков М.А., Белобелецкая М.В. Обзор современных разработок в области Х-лучевой фотодинамической терапии. Тихоокеанский медицинский журнал. 2025;(1):5-9. https://doi.org/10.34215/1609-1175-2025-1-5-9
For citation:
Shevchenko O.V., Shumatov V.B., Eliseeva E.V., Yuryeva K.A., Medkov M.A., Belobeletskaya M.A. Review of modern advances in X-ray photodynamic therapy. Pacific Medical Journal. 2025;(1):5-9. (In Russ.) https://doi.org/10.34215/1609-1175-2025-1-5-9
Традиционным методом лечения рака по-прежнему остается хирургическая резекция, зачастую дополняемая химиотерапией или лучевой терапией [1]. Однако эти вспомогательные методы имеют ряд серьезных побочных эффектов, а высокие дозы Х-лучей вызывают повреждение нормальных тканей. В связи с этим научный интерес представляет изучение новых терапевтических методик. Преимущества метода фотодинамической терапии (ФДТ) заключаются в сравнительно меньшей инвазивности, более коротком необходимом времени лечения и высокой селективности препаратов к опухолевым клеткам [2]. Определены три ключевых фактора для проведения эффективной ФДТ: применяемый препарат – фотосенсибилизатора (ФС), источник излучения и уровень генерируемых активных форм кислорода (АФК) [2].
Известно, что фотосенсибилизатор при облучении длиной волны (λ) света, соответствующей максимуму поглощения ФС, продуцирует цитотоксические АФК, а именно синглетный кислород (¹O2), что приводит к апоптозу или некрозу опухолевых клеток [2]. Однако диапазон таких длин волн расположен в ультрафиолетовой (10–390 нм) или видимой (390–770 нм) областях спектра, которые характеризуются ограниченной проницаемостью в биологические ткани (< 5 мм), что обуславливает возможность применения ФДТ только для лечение опухолей в поверхностных областях тканей и затрудняет выполнение неинвазивного лечения глубоких или объемных опухолей [2][3].
Х-лучи представляют электромагнитную волну высокой проникающей способности в сравнении с ультрафиолетовым, видимым или ближним инфракрасным светом [4]. Разработаны методики применения Х-лучей как источника возбуждающего света для фотодинамической терапии (Х-ФДТ) [4–6]. Однако большинство фотосенсибилизаторов (ФС) не способны напрямую поглощать энергию Х-лучей [7].
В настоящей работе приведен критический анализ исследований новых материалов, их биологических свойств и потенциала применения в Х-ФДТ, а также дальнейшие перспективы развития и становления этого направления лучевой терапии.
Одним из способов решения задачи по неспособности ФС поглощать высокоэнергетические Х-лучи непосредственно от источника является создание и применение люминесцентных наночастиц-сцинтилляторов (X-ray excited luminescent nanoparticles, XLNP), которые используются в качестве преобразователей энергии высокоэнергетических фотонов Х-лучей в низкоэнергетические фотоны (рис. 1). К этим последним относятся ультрафиолет (УФ)/видимый свет, возбуждающие ФС с генерацией активных форм кислорода (АФК).
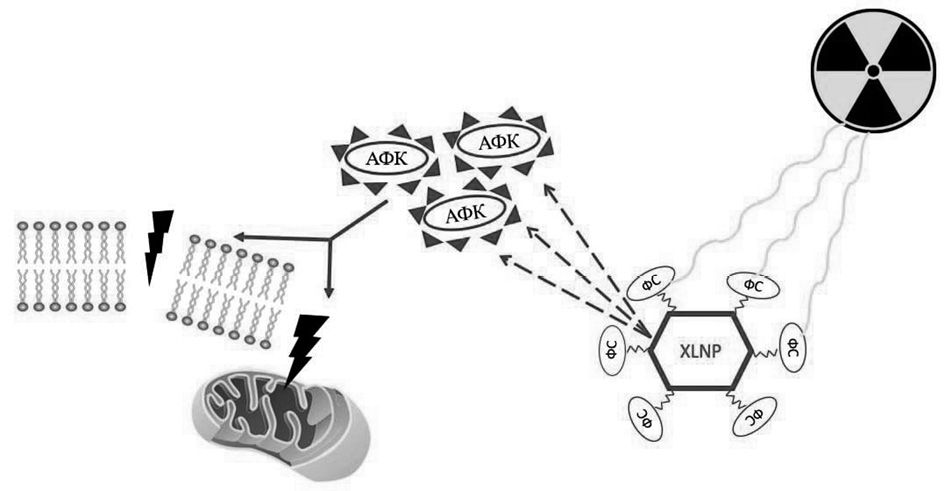
Рис. 1. Схема действия Х-лучей как источника возбуждающего света для фотодинамической терапии (Х-ФДТ) с участием наночастиц-сцинтилляторов (XLNP). АФК – активные формы кислорода, ФС – фотосенсибилизаторы.
Существует ряд требований, которым должен соответствовать XLNP [6–8]:
- спектры люминесценции XLNP должны соответствовать спектрам поглощения ФС для обеспечения эффективной активации ¹O2;
- XLNP должен иметь высокую эффективность люминесценции при возбуждении Х-лучами, достаточную, для активации ФС, осуществляемой посредством флуоресцентного резонансного переноса энергии (Förster resonance energy transfer, FRET) от молекулы-сцинтиллятора к фотосенсибилизатору;
- высокая растворимость вещества для обеспечения биосовместимости;
- низкая токсичность.
В настоящее время созданы материалы на основе комплексов металлов и органических сцинтилляторов, которые можно напрямую активировать Х-лучами при радиодинамической терапии. Основная их задача заключается в производстве ¹O2 и других активных радикалов [6][9]. В этом случае для достижения терапевтического эффекта требуется высокая доза облучения из-за неэффективного преобразования энергии, не позволяющей интенсивно продуцировать АФК [9].
Перспективным способом разработки материалов для Х-ФДТ является возможность создания комплексного соединения, содержащего фотосенсибилизатор и редкоземельный элемент. Для него характерна люминесценция в диапазонах длин волн от УФ и видимого до ближнего инфракрасного света за счет переходов 4f–4f или 4f–5d [10]. Широко применимы для биовизуализации наночастицы на основе лантанидов, возбуждаемые Х-лучами, поскольку им свойственны узкие спектральные линии и длительный срок жизни флуоресценции [10]. В настоящее время были успешно синтезированы различные наносцинтилляционные частицы путем легирования лантаноидами различных матриц-хозяев, в основном, включая фториды редкоземельных металлов (LaF3, CeF3, GdF3 и т. д.), оксиды редкоземельных металлов (Y2O3, Tb2O3 и т.д.), сульфид-оксиды редкоземельных металлов (Gd2O2S) и вольфраматы редкоземельных металлов (Gd2(WO4)3) и другие [10].
В 2021 году появились сообщения о создании 80-нм наночастиц SrAl2O4:Eu²⁺ (SAO) [11]. На поверхности наночастиц формировался слой плотного кремнезема и мезопористого кремнезема, а затем Merocyanine 540 (MC540) загружался в мезопоры (рис. 2). Итоговый размер материала M-SAO@SiO2 составил 407,4 ± 152,5 нм.
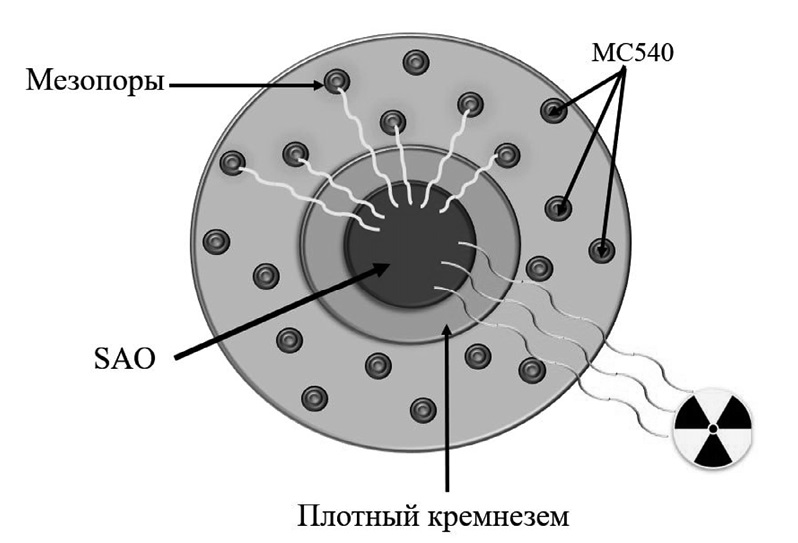
Рис. 2. Схема Х-ФДТ с участием нанокомпозита SAO@SiO2-MC540.
В экспериментах in vitro и in vivo показано, что низкодозовое облучение в 0,5 Гр в присутствии SAO@SiO2-MC540 значительно снижает жизнеспособность клеток на 62,0 ± 9,0%. На модели мышиного ксенографта U87MG отмечена значительная остановка роста опухоли, тогда как нормальные ткани не были затронуты.
В 2024 году разработана новая платформа Eu-PPIX@Hemin для лечения раковых клеток в условиях гипоксии после воздействия Х-излучением [7]. В процессе синтеза фотосенсибилизатор протопорфирин IX (PpIX) был допирован Eu (III) в составе NaYF4 (NaYF4:Eu) посредством гидрофобных взаимодействий. Далее наночастицы, содержащие NaYF4:Eu и PpIX, были конъюгированы с гидроксисукцинимидом (N-Hydroxysuccinimide, NHS)-активированном гемином (hemin-NHS) для создания финальной конструкции Eu-PpIX@Hemin. В этом исследовании трехвалентный европий выбран в качестве сцинтиллятора для введения в NaYF4 поскольку известно, что материалы на основе фторида широко используются в качестве основы для легирования ионами металлов [10]. В данном случае Eu³⁺ поглощает падающее излучение и передает энергию фотонов для возбуждения PpIX и генерации цитотоксического ¹O2 в препаратах Eu-PpIX@Hemin.
Включение гемина значительно повышает эффективность Х-ФДТ в условиях гипоксии (например, при 2% O2) за счет прямого генерирования кислорода, тем самым преодолевая ограничения, связанные с низкой доступностью О2. Имеются данные о синтезе биодоступного вещества с включением плохо растворимого ФС в структуру Eu-PPIX@Hemin [7]. Полученное вещество после облучения в дозе 0,5 Гр обеспечивает двойную генерацию как синглетного кислорода, так и гидроксильных радикалов (•OH), что приводит к повреждению двухцепочечной ДНК клеток эпителиального рака молочной железы (4T1-Luc).
P. Ge и др. [12] представили результаты получения липосом, содержащих вертепорфин (VP) и наночастиц золота 10 или 5 нм (Lipo-VP-10Au и Lipo-VP-5Au), а также состоящих только из VP (Lipo-VP) [12]. Показано, что Lipo-VP-10Au продуцировали наибольшее количество ¹O2 с увеличением примерно на 186%, в то время как для Lipo- VP-5Au на 129% в сравнении с липосомами, содержащими только VP (91%) после облучения в дозе 4 Гр. Такое увеличение продукции ¹O2 в присутствии наночастиц золота и объясняется радиосенсибилизирующими свойствами Au как тяжелого металла, т. е. способностью увеличивать дозы облучения в опухолевой ткани. Таким образом, молекулы VP в присутствии наночастиц золота способны эффективнее взаимодействовать с ионизирующим излучением, чем сам по себе VP, вызывая усиленную генерацию ¹O2. Авторами также были проведены исследования типа клеточной гибели клеток колоректальной карциномы линии HCT116. Определено, что после контакта с Lipo-VP-10Au и после облучения 4 Гр через 10 дней процент апоптотических и некротических составляет 26 и 19% соответственно [12].
Помимо наносцинтилляционных частиц на основе редкоземельных элементов некоторые наночастицы состава «оксид металла/сульфид металла–полупроводник» также способны возбуждаться Х-лучами для преобразования в длины волн света, активирующие фотосенсибилизаторы, с дальнейшей генерацией АФК [13].
Наночастицы ZnO после возбуждения Х-лучами испускают интенсивную флуоресценцию, а их длины волн испускания совпадают со спектром поглощения фотосенсибилизаторов на основе порфиринов [8]. Известной исследовательской группой, работающей в области получения новых фотосенсибилизаторов под руководством профессора Chen, подготовлены наночастицы оксида цинка (ZnO), конъюгированные с мезо-тетра(о-аминофенил) порфирином (meso-tetra(o-amino phenyl) porphyrin, MTAP). Обнаружено, что эффективность передачи энергии от наночастиц ZnO к MTAP достигала 83%. Связанная система ZnO-MTAP имела более низкую темновую цитотоксичность по сравнению с отдельно взятыми MTAP и ZnO. Та же группа исследовала свойства длительной люминесценции наночастиц ZnS:Cu, Co и сравнили интенсивность для разных концентраций введенных ионов Cu²⁺ и Co²⁺ [13]. Было обнаружено, что после воздействия Х-лучами интенсивность люминесценции наночастиц ZnS:Сu была наиболее высокой. Концентрация легирующего иона Cu²⁺ составила 0,07%, а Co²⁺ – 0,03%, что свидетельствует о передаче энергии даже при малом содержании. После прекращения возбуждения эффективность сцинтиллятора достаточна для применения в качестве источника энергии для ФС, что значительно сокращает дозу и время облучения.
Получен стабильный люминесцентный материал Zn3Ga2GeO8:-Cr³⁺, Yb³⁺ [14]. Наночастицы Er³⁺ в сочетании с мезопористыми силикатами являются новым нанотерапевтическим средством для визуализации и лечения опухолей печени in situ. Монодисперсные, однородные по размеру сферические 100 нм частицы Zn3Ga2GeO8:Cr³⁺, Yb³⁺, Er³⁺ (mZGGOs) после воздействия Х-лучами демонстрировали постоянную люминесценцию в ближнем инфракрасном диапазоне с λ = 706 нм. Показано, что после загрузки фотосенсибилизатора фталоцианина кремния (Si-PC), mZGGOs могут эффективно возбуждать ФС для производства ¹O2.
В аналогичных условиях молекула, в которой носителем является полимер полиэтиленгликоль (PEG) Si-PC@PEG-mZGGOs, после облучения показала значительное снижение жизнеспособности опухолевых клеток в сравнении с контрольными группами фосфатно-солевого буфера, mZGGOs и Si-PC, что указывает на эффективность Х-ФДТ в отношении гибели клеток гепатоцеллюлярной карциномы человека HepG2. На модели in vivo продемонстрирован устойчивый сигнал люминесценции в изолированной области опухоли печени через 24 часа после внутривенного введения наночастиц Si-PC@PEG-mZGGOs.
Коллективом авторов под руководством Rossi предложена гибридная наносистема на основе биосовместимых нанопроводов (nanowires, NW) SiC/SiOx, функционализированных с применением методов клик-химии ФС тетра(N-пропинил-4-аминокарбонилфенил) порфирином (H2TPACPP) [15]. Эффективность гибридной системы NW-H2TPACPP в качестве источника синглетного кислорода была исследована в растворе после воздействия излучением линейного ускорителя Linac Varian, мощностью 6 МВ, с помощью зонда Singlet Oxygen Sensor Green (SOSG). Установлено, что концентрация ¹O2 резко возрастает в зависимости от дозы воздействия (в Греях) и в 5 раз превышает по интенсивности значения, полученные для свободной молекулы порфирина H2TPACPP. Исследования in vitro были проведены на линии клеток карциномы легкого A549. Показано, что через 24 часа контакта наблюдается полное поглощение NW-H2TPACPP клетками. Таким образом, клетки после суточного контакта облучали 2 Гр в соответствии со стандартными условиями клинической лучевой терапии (однократный сеанс). Далее оценивали жизнеспособность опухолевых клеток на основании клоногенного анализа. Через 12 ч отмечено ингибирование пролиферации клеток как после облучения, так и без него. Для подтверждения этого результата в рамках дополнительного эксперимента провели однократное облучение в дозе 2 Гр после контакта клеток A549 с увеличенными до 100 и 500 мг/мл концентрациями. Подтверждено снижение уровня аденозинтрифосфата в клетках, что напрямую коррелирует с их снижающейся жизнеспособностью. Результаты получены при времени облучения в 20 сек против 90 сек для стандартного клинического лечения. В перспективе это важное обстоятельство может сократить время облучения и нахождения пациента в условиях психологического и физического дискомфорта внутри процедурной комнаты.
В качестве носителей ФС для Х-ФДТ в последнее время также привлекают внимание квантовые точки (quantum dots, QDs) [16]. Авторы сообщили о QDs, способных к возбуждению Х-лучами и состоящих из ядра CdSe и оболочки ZnS с размером частиц всего 2,1 нм, с включением фотосенсибилизатора Фотофрин [8]. Показана передача энергии по механизму FRET от QD к Фотофрину после воздействия Х-лучами (6 МэВ). Эффективность этого процесса зависит от соотношения Фотофрин/QD: при молярном соотношении 291:1 эффективность передачи энергии была близка к 100%. Эксперимент по воздействию Х-лучей на культуру клеток H460, находившуюся в контакте с Фотофрин/QD, показал меньшее количество жизнеспособных клеток в сравнении с контрольной облученной группой.
Заключение
Х-ФДТ обладает преимуществами высокой проникающей способности, неинвазивности и избирательности. Применение такой методики способно привести к усилению терапевтических эффектов при использовании низких доз воздействия (0,5 Гр). Однако метод Х-ФДТ еще не нашел клинического применения и находится на стадии разработки. Для успешного развития метода необходимо учесть при разработке новых материалов следующие аспекты.
- Длительность и интенсивность люминесценции – для более эффективной активации фотосенсибилизатора и, как следствие, повышения эффективности Х-ФДТ, а также возможности биовизуализации.
- Необходимость разработки биодоступных материалов, т. е. в виде раствора или наноразмерных веществ с равномерным распределением частиц.
- Выяснение точного механизма передачи энергии от сцинтиллятора к фотосенсибилизатору после воздействия Х-лучами.
- Введение таргетных молекул в разрабатываемые структуры для адресной доставки к месту опухоли.
Таким образом, исследования в области Х-ФДТ обладают большим научным потенциалом и при развитии биомедицинского материаловедения могут привести к созданию эффективной технологии в лечении рака.
Конфликт интересов: авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Источник финансирования: работа выполнена в рамках Программы стратегического академического лидерства «Приоритет 2030» (ФГБОУ ВО ТГМУ Минздрава России) и государственного задания ФГБУН Института химии ДВО РАН, тема «Направленный синтез и исследование строения и свойств новых веществ, материалов и покрытий (включая наноразмерные) для морских технологий и техники и различного функционального назначения» (FWFN(0205)-2022-0003).
Участие авторов:
Концепция и дизайн исследования – ЕЕВ, ММА, ШОВ
Сбор и обработка материала – ШОВ, БМВ
Написание текста – ШОВ, ЮКА
Редактирование – ЕЕВ, ММА, БМВ
Список литературы
1. Kaur R, Bhardwaj A., Gupta S. Cancer treatment therapies: traditional to modern approaches to combat cancers. Molecular biology reports. 2023;50(11):9663–76. doi: 10.1007/s11033-023-08809-3
2. Gunaydin G, Gedik ME, Ayan, S. Photodynamic therapy— current limitations and novel approaches. Frontiers in Chemistry. 2021;9:691697. doi: 10.3389/fchem.2021.691697
3. Algorri JF, López-Higuera JM, Rodríguez-Cobo L, Cobo A. Advanced light source technologies for photodynamic therapy of skin cancer lesions. Pharmaceutics. 2023;15(8):2075. doi:10.3390/pharmaceutics15082075
4. Vollmer M. Physics of the electromagnetic spectrum. Electromagnetic technologies in food science. 2021:1–32. doi:10.1002/9781119759522.ch1
5. Hosseini FS, Naghavi N, Sazgarnia A. A physicochemical model of X-ray induced photodynamic therapy (X-PDT) with an emphasis on tissue oxygen concentration and oxygenation. Scientific Reports. 2023;13(1);17882. doi: 10.1038/s41598-023-44734-y
6. He L, Yu X, Li W. Recent progress and trends in X-ray-induced photodynamic therapy with low radiation doses. ACS nano. 2022; 16(12): 19691–721. doi:10.1021/acsnano.2c07286
7. Maiti D, Yu H, An JS, Yamashita S, Naito M, Miyata K, Kim HJ. Dual Porphyrin‐Loaded Scintillating Nanoparticles Enhanced Photodynamic Therapy in Hypoxic Cancer Cells under X‐ray Irradiation. ChemBioChem. 2024: e202400838. doi: 10.1002/cbic.202400838
8. Yao B, Liu X., Zhang W, Lu H. X-ray excited luminescent nanoparticles for deep photodynamic therapy. RSC advances. 2023;13(43): 30133–50. doi: 10.1039/D3RA04984A
9. Lu L, Sun M, Lu Q, Wu T, Huang B. High energy X-ray radiation sensitive scintillating materials for medical imaging, cancer diagnosis and therapy. Nano Energy. 2023;79:105437. doi: 10.1016/j.nanoen.2020.105437
10. Hossain MK, Hossain S, Ahmed MH, Khan MI, Haque N, Raihan, GA. A review on optical applications, prospects, and challenges of rare-earth oxides. ACS Applied Electronic Materials. 2021;3(9):3715–46. doi: 10.1021/acsaelm.1c00682
11. Mushtaq A, Iqbal MZ, Tang J, Sun W. The wonders of X-PDT: an advance route to cancer theranostics. Journal of Nanobiotechnology. 2024; 22(1): 655. doi: 10.1186/s12951-024-02931-5
12. Gu X, Shen C, Li H, Goldys EM, Deng W. X-ray induced photodynamic therapy (PDT) with a mitochondria-targeted liposome delivery system. J Nanobiotechnology. 2020;18(1):87. doi: 10.1186/s12951-020-00644-z
13. Pashootan P, Saadati F, Fahimi H, Rahmati M, Strippoli R, Zarrabi A, Moosavi MA. Metal-based nanoparticles in cancer therapy: exploring photodynamic therapy and its interplay with regulated cell death pathways. International Journal of Pharmaceutics. 2024;649:123622. doi: 10.1016/j.ijpharm.2023.123622
14. Ge P, Yang X, Guo X, Tian Y, Liu S, Yue X, Li T. Up-converted and persistent luminescence properties of Zn1+ xGa2− 2xSnxO4: Cr3+, Yb3+, Er3+ phosphors. Journal of the Ceramic Society of Japan. 2023;131(1):1–7. doi: 10.1039/C9TC03882E
15. Rossi F, Bedogni E, Bigi F, Rimold T, Cristofolini L, Pinelli S, Salviati G. Porphyrin conjugated SiC/SiOx nanowires for X-rayexcited photodynamic therapy. Scientific reports. 2015;5(1):7606. doi: 10.1038/srep07606
16. Lin L, Song X, Dong X, Li B. Nano-photosensitizers for enhanced photodynamic therapy. Photodiagnosis and Photodynamic Therapy. 2021;36: 102597. doi: 10.1016/j.pdpdt.2021.102597
Об авторах
О. В. ШевченкоРоссия
Шевченко Ольга Вячеславовна – научный сотрудник Междисциплинарного лабораторного центра,
690002, Приморский край, Владивосток, пр-т Острякова, 2
В. Б. Шуматов
Россия
690002, Приморский край, Владивосток, пр-т Острякова, 2
Е. В. Елисеева
Россия
690002, Приморский край, Владивосток, пр-т Острякова, 2
К. А. Юрьева
Россия
690002, Приморский край, Владивосток, пр-т Острякова, 2
М. А. Медков
Россия
Владивосток
М. В. Белобелецкая
Россия
Владивосток
Рецензия
Для цитирования:
Шевченко О.В., Шуматов В.Б., Елисеева Е.В., Юрьева К.А., Медков М.А., Белобелецкая М.В. Обзор современных разработок в области Х-лучевой фотодинамической терапии. Тихоокеанский медицинский журнал. 2025;(1):5-9. https://doi.org/10.34215/1609-1175-2025-1-5-9
For citation:
Shevchenko O.V., Shumatov V.B., Eliseeva E.V., Yuryeva K.A., Medkov M.A., Belobeletskaya M.A. Review of modern advances in X-ray photodynamic therapy. Pacific Medical Journal. 2025;(1):5-9. (In Russ.) https://doi.org/10.34215/1609-1175-2025-1-5-9





































