Перейти к:
Особенности распределения HIF-1α- и HIF-2α-иммунопозитивных нейронов в коре головного мозга у старых крыс после экспериментального инфаркта миокарда
https://doi.org/10.34215/1609-1175-2025-1-34-39
Аннотация
Цель: сравнительное изучение количественного содержания HIF-1α- и HIF-2α-иммунопозитивных нейронов в префронтальной коре головного мозга крыс в разные временные периоды развития экспериментального инфаркта миокарда (ИМ).
Материалы и методы. Иммуногистохимическими методами изучали содержание HIF-1а- и HIF-2а-позитивных нейронов в коре головного мозга у крыс Вистар и через 15 и 30 и 45 суток после ИМ.
Результаты. У крыс контрольной группы иммуногистохимический маркер HIF-1α и HIF-2α в префронтальной коре головного мозга определяется в небольшом количестве бледно окрашенных нейронов. На 15-е сутки после моделирования ИМ количество HIF-1α-позитивных нейронов увеличивается почти на треть, а на 30-е сутки достигает максимального уровня. На 45-е сутки количество HIF1α-позитивных структур сокращается, но остается выше контрольного уровня, а маркированных HIF-2α в этот период достигает наибольших значений.
Заключение. Несмотря на сходство молекулярной структуры HIF-1α и HIF-2α, каждый из факторов вызывает экспрессию различных генов и неодинаковую продолжительность адаптации нейронов префронтальной коры к постинфарктной гипоксии. HIF-1α, по-видимому, отвечает за формирование срочной адаптации нейронов коры мозга к гипоксии, HIF-2α – долговременной. В период наиболее выраженного снижения индукции HIF-1α в нейронах коры мозга наблюдается активация HIF-2α, что указывает на скоординированное по времени участие обоих протеинов в обеспечении системной реакции организма.
Для цитирования:
Коцюба А.Е., Черток В.М., Романова Т.Е. Особенности распределения HIF-1α- и HIF-2α-иммунопозитивных нейронов в коре головного мозга у старых крыс после экспериментального инфаркта миокарда. Тихоокеанский медицинский журнал. 2025;(1):34-39. https://doi.org/10.34215/1609-1175-2025-1-34-39
For citation:
Kotsyuba A.E., Chertok V.M., Romanova T.E. Distribution features of HIF-1α- and HIF-2α-immunopositive neurons in the cerebral cortex in old rats after experimental myocardial infarction. Pacific Medical Journal. 2025;(1):34-39. (In Russ.) https://doi.org/10.34215/1609-1175-2025-1-34-39
При инфаркте миокарда (ИМ), как и при многих других хронических заболеваниях с нарушениями транспортной функции крови, органы и ткани постоянно испытывают недостаток кислорода [1][2][3]. Важное место в адаптации организма к циркуляторной гипоксии отводится индуцируемому гипоксией фактору-1 (Hypoxia-Inducible Factor-1, HIF-1) – специфическому регуляторному белку, активность которого увеличивается при снижении напряжения кислорода в крови [4]. HIF-1α долгое время рассматривался в качестве главного медиатора адаптивных процессов при гипоксии, однако в исследованиях последних лет было показано, что HIF-2α является не менее важным регулятором этих процессов [5]. Однако в обширной литературе, посвященной этому вопросу, мы не встретили материалов об особенностях экспрессии HIF-1α и HIF-2α в нейронах коры мозга в динамике развития ИМ.
Цель работы состояла в сравнительном изучении количественного содержания HIF-1α- и HIF-2α-иммунопозитивных нейронов (HIF-1α- и HIF-2α-нейроны) в префронтальной коре головного мозга крыс в разные временные периоды развития экспериментального ИМ.
Материалы и методы
Исследование выполнено на префронтальной коре 24-месячных белых крысах-самцах линии Вистар массой 280–320 г. Всех животных содержали на стандартном рационе в одинаковых условиях лабораторного вивария. Животных произвольно выделили в две группы: контрольную (n = 15) и экспериментальную (n = 23). Исследование проводилось в соответствии с требованиями «Правил лабораторной практики в Российской Федерации» (приказ МЗ РФ № 708-н от 23.08.2010 г.) и Директивы Европейского союза по защите животных, используемых в научных целях (2010/63/EU). При содержании животных и выведении их из эксперимента руководствовались законом «О защите животных от жестокого обращения» (гл. V, ст. 104679-ГД от 01.12.1999 г.). Протокол исследования утвержден на заседании локального этического комитета ФГБОУ ВО ТГМУ Минздрава России (протокол № 5 от 17.01.2022 г.).
Крыс помещали в индукционную камеру, в которой проводили ингаляцию паров севорана (Asika Queenborough LTD, Великобритания) до утраты двигательной активности и реакции на болевой раздражитель, после чего фиксировали на манипуляционном стенде. В асептических условиях осуществляли разрез кожи грудной клетки размером около 2 см, раздвигали грудные мышцы до появления реберных дуг и межреберных мышц. Затем контрольным животным операционную рану ушивали, а экспериментальным – через межреберный промежуток в толщу миокарда передней стенки сердца атравматичной иглой с тройным покрытием силиконом (30G SF Medical Products GMBH, Германия) вводили 0,25 мл 1,5% сосудистого склерозирующего препарата этоксисклорол (Kreissler Chemische Fabrik, Германия) по описанной ранее методике [6].
В экспериментальной группе погибли 8 крыс, оставшихся забивали декапитацией через 15, 30 и 45 суток после оперативного вмешательства. Головной мозг извлекали из полости черепа, фиксировали в течение 4 ч при 4 °С в 4% растворе параформальдегида, приготовленном на 0,1 М натрийфосфатном буфере (рН 7,4) и заливали в парафин общепринятым методом.
Иммуногистохимическое исследование префронтальной коры мозга проводили на серийных депарафинированных срезах толщиной 7 мкм, один из которых обрабатывали для выявления HIF-1α, следующий за ним – HIF-2α. Срезы монтировали таким образом, чтобы на стекле одновременно находились образцы, полученные от контрольных и экспериментальных животных каждой временной группы. После ингибирования эндогенной пероксидазы в 1% растворе H2O2 и подавления неспецифического связывания антител в 1% нормальной сыворотке лошади срезы инкубировали в течение 18 ч при 4 °С с моноклональными антителами мыши против HIF-1α и HIF-2α (разведение 1: 500; Abcam, Великобритания). Затем срезы промывали в нескольких сменах 0,1 М фосфатно-солевого буфера (PBS) (pH 7,2) и инкубировали 2 ч в растворе вторичных биотинилированных антител (Vector Labs, США) в разведении 1 : 200. После отмывания срезы инкубировали в течение 1 ч с авидин-биотин-пероксидазным комплексом (Vectastain Elite АВС Kit, Vector Labs, США) при температуре 22–24 °С в темноте, после чего их трижды промывали в PBS. Продукты реакции визуализировали с использованием хромогена (Peroxidase Substrate Kit, Vector NovaRED, SK-4800), контролируя процесс окраски под микроскопом. Инкубацию с первичными антителами осуществляли при 4 °С, обработку вторичными антителами и хромогеном выполняли в соответствии с рекомендациями фирм производителей. Некоторые срезы докрашивали 0,1% крезиловым фиолетовым по Нисслю.
Животных выводили из эксперимента декапитацией, затем вскрывали грудную полость и для верификации диагноза извлекали сердце. У экспериментальной группы животных на грудино-реберной поверхности сердца формируются ограниченные очаги, которые на 15-е, 30-е и 45-е сутки после оперативного вмешательства представлены небольшими (1–3 мм) рубцами сероватого цвета. У контрольных животных изменений макроструктуры сердца не отмечено.
Содержание иммунопозитивных нейронов изучали у каждого животного при объективе 40× на стандартной площади среза префронтальной коры равной 0,105 мм². Препараты просматривали под микроскопом Leica DMRXA (Leica, Германия) и фотографировали при помощи цифрового фотоаппарата Leica EC3 (Leica, Германия). Количественные исследования проводили на трех последовательных срезах каждого образца с помощью программы анализа изображения ImageScope (Leica, Германия). Статистическую обработку данных проводили в программе Statistica 10.0 (StatSoft, Inc.). Для оценки достоверности полученных результатов использовали критерий Манна – Уитни. Достоверными считались различия при p < 0,05. Результаты экспериментов выражали как среднее арифметическое (М) ± стандартная ошибка среднего (SEM).
Результаты исследования
Иммуногистохимический маркер HIF-1α выявляется в небольшом количестве нейронов, артериол и капилляров коры мозга у контрольных и экспериментальных животных (рис. 1, а–в), HIF-2α – только у крыс с ИМ (рис. 1, г, д). Во всех случаях преципитат в иммунопозитивных структурах выпадает в виде мелких гранул, окрашивая их в зависимости от плотности отложения продукта реакции в различные оттенки коричневого цвета.

Рис. 1. HIF-1α-иммунопозитивные (а–в) и HIF-2α-иммунопозитивные (г, д) нейроны в префронтальной коре головного мозга у контрольных крыс (а), а также через 15 (б), 30 (г) и 45 (в, д) суток развития ИМ. Ув. 200×
Наиболее выраженные количественные изменения HIF-1α-нейронов наблюдаются на 15-е сутки после моделирования ИМ, когда их содержание по сравнению с контрольными показателями увеличивается на 24,7% (p < 0,05), достигая максимального уровня (рис. 2). В этот период на срезах лобной доли мозга выявляются многочисленные нейроны с интенсивной реакцией, окрашенные в темно-коричневый цвет (рис. 1, б). Затем количество этих клеток сокращается, тем не менее остается значимо выше контрольных цифр (р < 0,05). На 45-е сутки развития ИМ на препаратах определяется относительно небольшое число HIF-1α иммунопозитивных нейронов, в большинстве из которых плотность отложения гранул преципитата невысока, в результате чего клетки окрашены в желтовато-коричневый цвет (рис. 1, в).
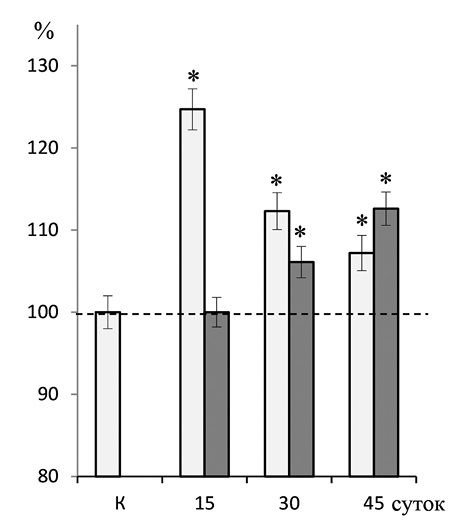
Рис. 2. Динамика содержания HIF-1α-позитивных (светлые столбики) и HIF-2α-позитивных (темные столбики) нейронов в коре мозга у крыс при развитии ИМ. Для HIF-1α за 100% принята величина показателя у контрольных животных; для HIF-2α – за 100% принята величина показателя на 15-е сутки после моделирования ИМ; * отмечены достоверные отличия от этих показателей (р < 0,05). К – контроль, 15, 30 и 45 суток после моделирования ИМ.
Цифры для построения диаграмм в (%) к рис. 2
HIF-1 | HIF-2 | |
К | 100 ± 2,0 | |
15 | 124,7 ± 2,3 | 100 ± 1,6 |
30 | 112,3 ± 2,1 | 106,1 ± 1,8 |
45 | 107,2 ± 1,9 | 112,6 ± 2,0 |
Особенности количественных преобразований HIF-2α-нейронов в префронтальной коре в разные сроки развития ИМ представлены на диаграмме (рис. 2). Клетки, маркированные HIF-2α, начинают выявляться в коре мозга в количестве достаточном для статистических исследований только на 30-е сутки ИМ. На этом этапе развития ИМ большинство иммунопозитивных нейронов окрашены в желтовато-коричневый цвет (рис. 1, г). Однако на 45-е сутки их количество увеличивается почти вдвое (р < 0,05). В этот период на срезах лобной доли мозга особенно часто встречаются нейроны темно-коричневого цвета с высокой плотностью отложения продукта реакции, хотя рядом с ними нередко рядом с ними находятся нейроны с умеренной и низкой интенсивностью реакции (рис. 1, д).
Обсуждение полученных данных
К настоящему времени представлены убедительные доказательства причинно-следственной связи между поражением сердечно-сосудистой системы и изменениями, проходящими в центральной нервной системе [1][2]. Для пациентов пожилого возраста, составляющих основной контингент кардиологических больных, расстройства психической деятельности имеют выраженные негативные последствия, катастрофически изменяя качество жизни [7][8]. Снижение когнитивных функций у больных, перенесших ИМ, часто играет более важную роль в социально-трудовой реабилитации, чем прямые последствия самого ИМ [2].
Предполагается, что психическая патология, нередко формирующаяся в постинфарктном периоде, во многом обусловлена гемодинамическими изменениями, приводящими к циркуляторной гипоксии различных отделов головного мозга, включая его когнитивные центры [2][4]. К таким центрам относится, в том числе, префронтальная кора – передняя часть лобных долей, имеющая многочисленные связи с другими кортикальными образованиями, субкортикальными и стволовыми нейронами.
Полученные нами данные свидетельствуют о клеточно-специфических особенностях экспрессии HIF-1α и HIF-2α в префронтальной коре экспериментальных животных, что, возможно, связано с различиями интенсивности их кислород-зависимой деградации, являясь определяющим фактором разной чувствительности нейронов к постинфарктной гипоксии. Даже в одноименных популяциях клеток HIF-1α и HIF-2α могут вызывать экспрессию различных генов, обеспечивающих, в том числе, неодинаковую продолжительность адаптации клеток к гипоксии [9]. При развитии гипоксии HIF-1α накапливается в клетке и в комплексе с HIF-1β воздействует на так называемые гипоксия-реакционные элементы (hypoxia response elements, HRE), содержащиеся в генах, продукты которых опосредуют работу адаптивных белков, связанных с энергетическим метаболизмом, эритропоэзом, апоптозом, пролиферацией клеток и другими процессами, обеспечивающими приспособительные реакции организма к гипоксии [9]. Активация HRE является ключевым моментом в цепи событий, начинающихся в клетке после того, как происходит снижение концентрации кислорода в ее окружении. Взаимодействуя с энхансером гена эритропоэтина, HRE опосредует увеличение выработки эритроцитов, открытие нефункционирующих капилляров и интенсификации неоангиогенеза [10].
Тем не менее, по нашим данным в префронтальной коре контрольных животных маркер HIF-1α определяется в ограниченной популяции нейронов, лежащих в поверхностных и глубоких слоях неокортекса. И хотя плотность отложения продукта реакции в большинстве таких клеток невелика, его должно быть достаточно для базовой индукции генов, обеспечивающих поддержание функциональной активности клетки и прежде всего синтез энергии [10][11]. В нормоксических условиях экспрессия HIF-1α в тканях поддерживается несколькими процессами, но в первую очередь постоянно протекающей в цитозоле протеасомной деградации, инициируемой двумя независимыми кислород-зависимыми реакциями: пролил и аспарагин гидроксилированием с последующей убиквитинацией [4].
HIF-1α и HIF-2α относятся к одному семейству стабилизирующих гипоксию факторов и соединяются с идентичной мишенью в последовательности ДНК [9][12]. Однако морфофункциональная организация каждой из этих регуляторных молекул имеет свои особенности. Как показали наши наблюдения, иммуногистохимический маркер HIF-1α выявляется в коре мозга как у контрольных, так и экспериментальных животных, тогда как HIF-2α-позитивные структуры – только в поздние сроки постинфарктного периода. Через 15 суток после моделирования ИМ содержание HIF-1α-нейронов достигает наибольших значений, тогда как интенсивно окрашенные нейроны, маркированные HIF-2α, в большом количестве определяются в коре мозга лишь на 45-е сутки ИМ, когда содержание HIF-1α-нейронов сокращается до минимального уровня, что указывает на скоординированное по времени участие обоих протеинов в обеспечении системной реакции организма на гипоксию.
Несмотря на очень близкое строение этих протеинов, каждый из них контролирует определенные биологические характеристики клеток, связанные, в том числе, с ответной реакцией на гипоксию. Ранее в жестких гипоксических условиях на культуре эндотелиальных клеток было показано, что из-за уменьшения стабильности мРНК повышенный уровень экспрессии HIF-1α через короткое время возвращается к исходным значениям, тогда как, содержание мРНК HIF-2α еще некоторое время остается на высоком уровне [4][12].
Адаптация к гипоксии обеих регуляторных молекул осуществляется универсальным путем: через конформационные изменения HIF, увеличение продукции эритроцитов и образование новых путей их доставки [9][10][11]. В нейронах развивается дисфункция митохондрий, провоцирующая нарушение энергетического метаболизма [13]. Одновременно увеличивается накопление фосфоркреатина и его расходование на синтез АТФ, что является дополнительным фактором, способствующим адаптации к гипоксии [14].
Тем не менее, приведенные выше данные, свидетельствуют о специфичности работы HIF-1α и HIF-2α в нейронах префронтальной коры головного мозга у крыс в процессе развития ИМ. Даже в одноименных популяциях клеток HIF-1α и HIF-2α могут вызывать экспрессию различных генов, обеспечивающих, в том числе, разную продолжительность адаптации нейронов к гипоксии. HIF-1α, по-видимому, отвечает за формирование срочной адаптации нейронов коры мозга к гипоксии, HIF-2α – долговременной.
Гипоксия является типовым патологическим процессом, сопровождающим различные хронические болезни, включая ИМ. Вследствие низкого сердечного выброса и развития гипоперфузии доставка кислорода к тканевым структурам мозга сокращается до уровня, недостаточного для адекватного обеспечения метаболизма, что вызывает изменения всех компонентов нейро-сосудистых единиц [15]. При ИМ, наблюдающемся в пожилом возрасте, системные нарушения накладываются на возрастные изменения, вследствие чего адаптационные резервы быстро истощаются, а явления хронической гипоксии нарастают. Появляются нейродегенеративные изменения, в первую очередь, кислород чувствительных нейронов и белого вещества лобной коры, и как следствие, усугубляются когнитивные нарушения функций мозга.
Заключение
Несмотря на очень близкое строение HIF-1α и HIF-2α, каждый из них вызывает экспрессию различных генов, обеспечивающих неодинаковую продолжительность адаптации нейронов префронтальной коры к постинфарктной гипоксии. HIF-1α, вероятно, отвечает за формирование срочной адаптации нейронов коры мозга к гипоксии, в то время как HIF-2α – долговременной. В период наиболее выраженного снижения индукции HIF-1α в нейронах коры мозга наблюдается активация HIF-2α, что указывает на скоординированное по времени участие обоих протеинов в обеспечении системной реакции организма.
Конфликт интересов: авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Источник финансирования: авторы заявляют о финансировании проведенного исследования из собственных средств.
Участие авторов:
Концепция и дизайн исследования – ЧВМ,
Сбор и обработка материала – КАЕ
Статистическая обработка – КАЕ, РТЕ
Написание текста – ЧВМ
Редактирование – ЧВМ
Список литературы
1. Battaglini D, Robba C, Lopes da Silva A, dos Santos Samary C, Leme Silva P, Dal Pizzol F, Pelosi P, Rocco PRM. Brain–heart interaction after acute ischemic stroke. Crit Care. 2020;24(163):2– 12. doi: 10.1186/s13054-020-02885-8
2. Breteler MM, Claus JJ, Grobbee DE, Hofman A. Cardiovascular disease and distribution of cognitive function in elderly people: the Rotterdam study. BMJ. 1994; 308(6944):1604–8. doi: 10.1136/bmj.308.6944.1604
3. Бойцов С.А., Самородская И.В. Сердечно-сосудистые заболевания и когнитивные нарушения. Журнал неврологии и психиатрии им. С.С. Корсакова. 2022;122(7):7–13. doi: 10.17116/jnevro20221220717
4. Škrlec I, Kolomeichuk SN. Hypoxia-inducible factor-1α in myocardial infarction. World J Cardiol., 2024;16(4):181–5. doi: 10.4330/wjc.v16.i4.181
5. Triner D, Xue X, Schwartz AJ, Jung I, Colacino JA, Shah YM. Epithelial Hypoxia-Inducible Factor 2α Facilitates the Progression of Colon Tumors through Recruiting Neutrophils. Mol. Cell. Biol. 2017;26(3):e00481–00416. doi: 10.1128/MCB.00481-16
6. Невзорова В.А., Черток В.М., Бродская Т.А., Рощенко Р.В., Плехова Н.Г. Экспериментальное моделирование инфаркта миокарда у старых крыс. Тихоокеан. мед. журнал. 2022;2:72– 4. doi: 10.34215/1609-1175-2022-2-72-74
7. Левин О.С. Когнитивные нарушения в практике терапевта: заболевания сердечнососудистой системы. CONSILIUM MEDICUM. 2009;11(2):55– 61.
8. Jinawong K, Apaijai N, Chattipakorn N, Chattipakorn SC. Cognitive impairment in myocardial infarction and heart failure. Acta Physiol (Oxf). 2021;232(1):e13642. doi: 10.1111/apha.13642
9. Jaśkiewicz M, Moszyńska A, Króliczewski J. Cabaj A, Bartoszewska S, Charzyńska A, Gebert M, Dąbrowski M. Collawn JF, Bartoszewski R. The transition from HIF-1 to HIF-2 during prolonged hypoxia results from reactivation of PHDs and HIF1A mRNA instability. Cell Mol Biol Lett. 2022;27:109. doi: 10.1186/s11658-022-00408-7
10. Kietzmann T. Hypoxia-inducible erythropoietin expression: details matter. Haematologica 2020;105(12):2704–6. doi.org/10.3324/haematol.2020.261966
11. Tang Y-Y, Wang D-C, Wang Y-Q, Huang A-F, Xu W-D. Emerging role of hypoxia-inducible factor-1α in inflammatory autoimmune diseases: A comprehensive review. Front. Immunol. 2023;13:1073971. doi: 10.3389/fimmu.2022.1073971
12. Albanese A, Daly LA, Mennerich D, Kietzmann T, Sée V. The Role of Hypoxia-Inducible Factor Post-Translational Modifications in Regulating Its Localisation, Stability, and Activity. International Journal of Molecular Sciences. 2021;22(1):268. doi: 10.3390/ijms22010268
13. Невзорова В.А., Черток В.М., Бродская Т.А., Селюкова П.А. Дисфункция митохондрий и сосудистое старение при коморбидной патологии. Тихоокеан. мед. журнал. 2022;1:10–6. doi: 10.34215/1609-1175-2022-1-10-16
14. Бонь Е.И., Зиматкин С.М., Максимович Н.Е. Влияние гипоксии на морфофункциональные характеристики нейронов мозга и молекулярные маркеры ишемической гипоксии. Вестник Смоленской гос. мед. академии. 2021;20(1):51–6. doi: 10.37903/vsgma.2021.1.8
15. Chertok VM, Nevzorova VA, Zakharchuk NV. Comparative study of HIF-1α- and HIF-2α-immunopositive neurons and capillaries in rat cortex under conditions of tissue hypoxia. Bull. Experim. Biol., Med. 2018;165(4):516–20. doi: 10.1007/s1057-018-4207-6
Об авторах
А. Е. КоцюбаРоссия
Черток Виктор Михайлович – д-р мед. наук, профессор, заведующий кафедрой анатомии человека,
69002, г. Владивосток, пр-т Острякова, 2
В. М. Черток
Россия
69002, г. Владивосток, пр-т Острякова, 2
Т. Е. Романова
Россия
69002, г. Владивосток, пр-т Острякова, 2
Рецензия
Для цитирования:
Коцюба А.Е., Черток В.М., Романова Т.Е. Особенности распределения HIF-1α- и HIF-2α-иммунопозитивных нейронов в коре головного мозга у старых крыс после экспериментального инфаркта миокарда. Тихоокеанский медицинский журнал. 2025;(1):34-39. https://doi.org/10.34215/1609-1175-2025-1-34-39
For citation:
Kotsyuba A.E., Chertok V.M., Romanova T.E. Distribution features of HIF-1α- and HIF-2α-immunopositive neurons in the cerebral cortex in old rats after experimental myocardial infarction. Pacific Medical Journal. 2025;(1):34-39. (In Russ.) https://doi.org/10.34215/1609-1175-2025-1-34-39





































