Перейти к:
Случай нестандартного течения трансплантации почки
https://doi.org/10.34215/1609-1175-2025-1-82-85
Аннотация
Подбор функционального донорского органа остается ключевой проблемой пересадки почки. Детальное обследование реципиента и тщательный подбор донорского органа остается залогом хорошей результативности пересадки, однако рост количества пациентов, ожидающих пересадку почки, отсутствие перспектив в достаточном количестве и качестве донорского материала неизбежно ведут к расширению критериев отбора органов для трансплантации. Одним из рациональных способов увеличения количества трансплантаций почек является забор органов у доноров с расширенными критериями. В связи с этим трансплантация почек с пороком удвоения, а также разработка алгоритма ведения таких пациентов приобретает актуальное значение. Представлен клинический случай нестандартной пересадки удвоенной почки, демонстрируются этапы исправления аномалии и результативность трансплантации. Порок удвоения почек и мочеточников не является противопоказанием для трансплантации органа, нуждается в коррекции отклонения во время или после пересадки и разработки индивидуального плана ведения пациента.
Для цитирования:
Шульга И.В., Ежова Т.С., Антонов М.В., Белов С.А. Случай нестандартного течения трансплантации почки. Тихоокеанский медицинский журнал. 2025;(1):82-85. https://doi.org/10.34215/1609-1175-2025-1-82-85
For citation:
Shul`ga I.V., Ezhova T.S., Antonov M.V., Belov S.A. Case of abnormal course of kidney transplantation. Pacific Medical Journal. 2025;(1):82-85. (In Russ.) https://doi.org/10.34215/1609-1175-2025-1-82-85
Пересадка почки и подбор функционального донорского органа остаются ключевой проблемой трансплантологии [1–3]. С учетом всех клинических требований к донору круг потенциальных возможностей пересадки значительно сужается. Удвоение почки как аномалии развития увеличивает риски осложнений со стороны донорских мочеточников, поэтому многие трансплантологи считают такие почки относительным противопоказанием к пересадке [4][5].
Пороки удвоения почек и мочеточников достигают 10% среди врожденных патологий мочевыделительной системы. При полном удвоении образуются две лоханки с общим кровоснабжением и отдельно отходящие мочеточники. Последние встречаются у 7% пациентов с пороками удвоения. Примерно в половине случаев каждый сегмент удвоенной почки имеет изолированное кровообращение из аорты [6–8]. При полном удвоении с двойной чашечно-лоханочной системы и раздвоенным мочеточником симптоматика обычно отсутствует до момента развития патологий смежных органов или болезней почек. Поэтому дополнительные методы исследований не позволяют четко выявить вид аномалии, а лишь хирургическое вмешательство может определить характер удвоения.
Число пациентов с пятой стадией хронической болезни почек, которые нуждаются в трансплантации, неуклонно растет, вследствие чего увеличиваются сроки ожидания [9][10]. Поэтому возникает необходимость расширения показаний для изъятия донорских органов. Трансплантация почек с пороком удвоения, а также разработка алгоритма ведения таких пациентов приобретает актуальное значение.
Клинический случай
Пациенту К. 54 лет в 2006 г. установлено поликистозное поражение почек. Прогрессирование заболевания привело к хронической почечной недостаточности, а в 2016 г. установлена ее терминальная стадия. Хроническая болезнь почек перешла в 5Д-стадию со скоростью клубочковой фильтрации менее 30 мл/мин/1,73 м². Поэтому пациенту с марта 2016 г. начали проводить заместительную почечную терапию методом программного гемодиализа. Открытие службы трансплантации Приморского края в 2020 году позволило включить пациента в лист ожидания на пересадку почки. Для профилактики рецидивирующей инфекции и ургентных состояний в ноябре 2021 г. пациенту провели превентивную предтрансплантационую двустороннюю (билатеральную) нефрэктомию. Морфологическое исследование препарата подтвердило клинический диагноз: аутосомно-доминантная поликистозная болезнь с преимущественным поражением почек.
Забор донорской почки выполнили 06.10.2022 г. При проверке почечного трансплантата от посмертного донора на столе (back-table preparation) оценили состояние сосудов и паренхимы, выявили два мочеточника, две почечные артерии, одну почечную вену. Пациенту 07.10.2022 г. провели аллотрансплантацию трупной почки слева (правая почка). Во время операции наложили сосудистые анастомозы с подвздошными сосудами и неоуретероцистоанастомоз на стенте. Одновременно выполнили начальную профилактику отторжения трансплантата стероидами (метилпреднизолон) с последующей комбинированной терапией ингибитором кальциневрина (такролимус) в сочетании с ингибитором инозинмонофосфатдегидрогеназы (микофенолата мофетил).
К третьим суткам лабораторное исследование определило гемоглобин на цифрах 88 г/л (120–160), эритроциты – 2,8 × 10¹²/л (3,9–5), лейкоциты – 10,5 × 10⁹/л (3,9–9), креатинин – 213 ммоль/л (62–115), мочевину – 15 ммоль/л (1,7–8,3). При анализе мочи удельный вес составил 1,03 (1,01–1,025), белок – 3,27 г/л (0–0,1), эритроциты – до 9168 в поле зрения, лейкоциты – 23 в поле зрения. У пациента сохранялась полиурия с суточным диурезом до пяти литров. При традиционном послеоперационном течении следующим этапом 19.10.2022 г. выполнили удаление стента. Кроме того, пациенту провели пластику вентральной грыжи, возникшей в проекции послеоперационного рубца после оперативного вмешательства.
Спустя две недели гладкого течения лабораторные анализы установились на цифрах: гемоглобин – 99 г/л, эритроциты – 3,3 × 10¹²/л, лейкоциты – 9,4 × 10⁹/л, креатинин – 130 ммоль/л, мочевина – 10,4 ммоль/л. В общем анализе мочи определили удельный вес – 1,03 (1,01–1,025), белок на цифрах 0,166 г/л (0–0,1), эритроциты – 13 в поле зрения, лейкоциты – 27 в поле зрения. Количество выделяемой мочи приблизилось к нормурии (2,2 литра/сутки). Ультразвуковым исследованием (УЗИ) с дуплексным сканированием левой подвздошной области оценили трансплантат размерами 110 × 50 × 55 мм, объемом до 155 см³ с четким ровным контуром. Корковое вещество почки имело однородную структуру, обычной эхогенности. Толщина почечной паренхимы составила 15 мм, размер чашечно-лоханочной системы до 10 мм. Сосудистые анастомозы проходимы. Кровоток общей почечной артерии на уровне устья Vs – 100 см/сек, Rl – 0,76 у. е.; сегментарных артерий Vs – 53 см/сек, Rl – 0,67 у. е. Кровоток в режиме венозного окрашивания полный, фазный. Структура и кровоток трансплантата были оценены как в переделах допустимых значений.
Спустя месяц клинические анализы составили: гемоглобин – 106 г/л, эритроциты – 3,6 × 10¹²/л, лейкоциты – 9,7 × 10⁹/л, креатинин – 93 ммоль/л, мочевина – 6,7 ммоль/л. В общем анализе мочи удельный вес составил 1,02 (1,01–1,025), белок на цифрах – 0,099 г/л (0–0,1), лейкоциты – 6 в поле зрения. Диурез адекватный. Продолжали проводить многокомпонентную иммуносупрессивную терапию с индивидуальным подбором Токролимуса, Метилпреднизолона и Микрофенлата мефетила, которую пациент переносил хорошо. Контрольная мультиспиральная компьютерная томография (МСКТ) с контрастом определила функционирующую трупную почку с удовлетворительным кровотоком (рис. 1), подтвержденным УЗИ-исследованием, поэтому больного выписали в удовлетворительном состоянии на амбулаторное наблюдение.
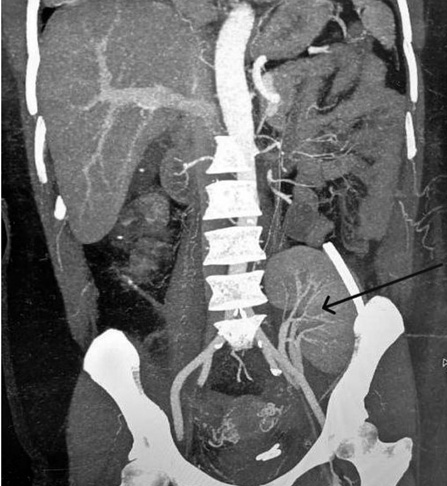
Рис. 1. МСКТ-изображение живота пациента в фронтальной проекции с контрастированием (артериальная фаза): почечный трансплантат определяется на наружной подвздошной артерии, равномерное накопление контрастного вещества в почке плотностью до 107 HU, паренхима однородной структуры (стрелка).
Спустя два месяца после пересадки трупной почки у пациента появилась распирающая боль в области имплантата, повысилась температура, снизился диурез, появилась стойкая лейкоцитурия. Проведенное клиническое, лабораторное обследование, УЗИ-диагностика, МСКТ-сканирование с контрастным веществом установили нарушение проходимости мочеточника трансплантата (рис. 2).

Рис. 2. МСКТ-изображение (реконструкция) малого таза пациента в фронтальной проекции с контрастированием (нефрографическая фаза): заполнение чашечно-лоханочной системы, мочеточника, мочевого пузыря; перегиб в области слияния удвоенного мочеточника (стрелка).
Пациенту выполнили оперативное вмешательство с ревизией структур имплантата и установили причину (перегиб мочеточника вследствие избыточной длины) провели реконструкцию пузырно-мочеточникового анастомоза и сформировали новое устье по типу «двустволки». В раннем послеоперационном периоде отмечено длительное подтекание мочи по дренажам с формированием затеков в ретровезикальное пространство. Мочевые затеки устранены пункционным методом под контролем УЗИ. Через две недели у больного удалили стент мочеточника. Клинико-лабораторные показатели пришли в норму. Структура и кровоток трансплантата в допустимых пределах, поэтому стационарное лечение закончено с хорошим эффектом.
Спустя 4 месяца пациент вновь обратился с затруднением оттока мочи. Кроме того, появились распирающие боли в области пересаженной почки, субфебрильная температура. Ультразвуковое исследование подтвердило наличие гидронефроза, а рентген-диагностика c контрастным веществом выявила облитерацию пузырно-мочеточникового соустья. Пациенту в стационаре наладили адекватный отток мочи пункционной нефростомой под контролем УЗИ (рис. 3).
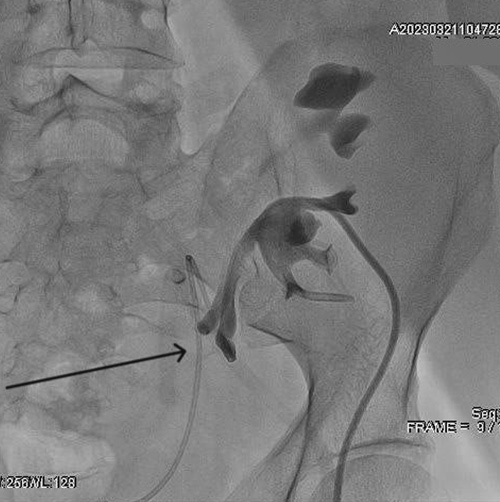
Рис. 3. Рентгенограмма чашечно-лоханочной системы при антеградной пиелоуретерографии. Мочеточники расширены и деформированы, нарушение проходимости пузырно-мочеточникового соустья (стрелка).
Формирование стриктуры анастомоза потребовало повторной коррекции и устранения стеноза, что достигнуто путем иссечения культи мочеточника и формированием нового антирефлюксного соустья на единой площадке из двух мочеточников трансплантата. Проходимость мочеточников восстановлена, клинические анализы вернулись к удовлетворительным цифрам. Параллельно у пациента установлен сахарный диабет 2-го типа, субкомпенсация, который потребовал дополнительной коррекции терапии.
Обследование пациента через год установило наличие у трансплантата удовлетворительного кровотока и адекватного диуреза (до 1,5 литра/сутки), отсутствие клиники почечной недостаточности и признаков имплантационного конфликта. Иммуносупрессивная терапия сбалансирована.
Представленный клинический пример лечения пациента с пересаженной удвоенной почкой демонстрирует этапность ведения с периода подготовки трансплантата до нормализации работы органа. На разных ступенях послеоперационного периода хирурги трансплантологи столкнулись с несколькими проблемами: возникновение послеоперационной вентральной грыжи, что согласно данным литературы может достигать 14% случаев; затем развитие стеноза мочеточникового соустья, которое встречается до 11% трансплантаций [5][6]. Известно, что основной причиной раннего возникновения сужения мочеточникового анастомоза остается технические погрешности, а в позднем периоде (более полугода) является поствоспалительный или ишемический фиброз. Представленный клинический случай демонстрирует сочетанную причину осложнения, которая обусловлена рисками выбора потенциально «скомпрометированного» органа – удвоенной почки. Детальное обследование реципиента и тщательный подбор донорского органа остается залогом хорошей результативности пересадки. Однако рост количества пациентов, ожидающих пересадку почки, отсутствие перспектив в достаточном количестве и качестве донорского материала неизбежно ведет к расширению критериев отбора органов для трансплантации. Алгоритм ведения пациентов от доноров с расширенными критериями нуждается в разработке и дальнейшем изучении.
Заключение
Пороки удвоения почек и мочеточников не являются противопоказанием для трансплантации органа, однако нуждаются в коррекции аномалии во время или после пересадки и разработки индивидуального плана дальнейшего ведения пациента.
Конфликт интересов: авторы декларируют отсут-
ствие явных и потенциальных конфликтов интересов,
связанных с публикацией настоящей статьи.
Источник финансирования: авторы заявляют о фи-
нансировании проведенного исследования из собст-венных средств.
Участие авторов:
Концепция и дизайн исследования – ШИВ
Сбор и обработка материала – ЕТС, АМВ
Написание текста – БСА
Список литературы
1. Готье С.В., Хомяков С.М. Донорство и трансплантация органов в Российской Федерации в 2019 году. XII сообщение регистра Российского трансплантологического общества. Вестник трансплантологии и искусственных органов. 2020;22(2):8–34. doi: 10.15825/1995-1191-2020-2-8-34
2. Kramer A, Pippias M, Noordzij M, et al. The European Renal Association - European Dialysis and Transplant Association (ERA-EDTA) Registry Annual Report 2016: a summary. Clin Kidney J. 2019;12(5):702–20. doi: 10.1093/ckj/sfz011
3. Mahillo B, Carmona M, Álvarez M, Noel L, Matesanz R. Global Database on Donation and Transplantation: goals, methods and critical issues (www.transplant-observatory.org). Transplant Rev (Orlando). 2013;27(2):57–60. doi: 10.1016/j.trre.2013.01.001
4. Hevia V, Gómez V, Hevia M, Lorca J, Santiago M, Dominguez A, Álvarez S, Díez V, Gordaliza C, Burgos FJ. Troubleshooting Complex Vascular Cases in the Kidney Transplant Recipient: Vascular Anomalies, Challenging Vessel Diseases, and Procedural Disasters. Curr Urol Rep. 2020;21(1):7. doi: 10.1007/s11934-020-0958-5. PMID: 32020365
5. Wood-Trageser MA, Xu Q, Zeevi A, Randhawa P, Lesniak D, Demetris AJ. Precision transplant pathology. Curr Opin Organ Transplant. 2020;25(4):412–9. doi: 10.1097/MOT.0000000000000772
6. Готье С.В., О.Е. Гичкун, С.В. Головинский Трансплантология и искусственные органы: учебник. Москва: Лаборатория знаний, 2022.
7. Прокопенко Е.И., Ватазин А.В., Щербакова Е.О., Кантария Р.О. Посттрансплантационный сахарный диабет у реципиентов ренального трансплантата: опыт одного центра. Нефрология. 2017;21(6):20–8. doi: 10.24884/1561-6274-2017-21-6-20-28
8. Хаджибаев Ф.А., Шарипова В.Х., Султанов П.К. Анализ осложнений после родственной трансплантации почки: опыт одного центра. Трансплантология. 2021;13(1):63– 73. doi: 10.23873/2074-0506-2021-13-1-63-73
9. Carrier AN, Verma A, Mohiuddin M, Pascual M, Muller YD, Longchamp A, Bhati C, Buhler LH, Maluf DG, Meier RPH. Xenotransplantation: A New Era. Front Immunol. 2022;9;13:900594. doi: 10.3389/fimmu.2022.900594 10.Mahmud N, Serper M. Rethinking Transplant Quality: New Performance Measures and Wait-List Prioritization. Liver Transpl. 2020;26(12):1564–5. doi: 10.1002/lt.25914
Об авторах
И. В. ШульгаРоссия
Владивосток
Т. С. Ежова
Россия
Владивосток
М. В. Антонов
Россия
Владивосток
С. А. Белов
Россия
Белов Сергей Анатольевич – д.м.н., торакальный хирург,
690950, Владивосток, о. Русский. пос. Аякс, 10, кор. № 25
Рецензия
Для цитирования:
Шульга И.В., Ежова Т.С., Антонов М.В., Белов С.А. Случай нестандартного течения трансплантации почки. Тихоокеанский медицинский журнал. 2025;(1):82-85. https://doi.org/10.34215/1609-1175-2025-1-82-85
For citation:
Shul`ga I.V., Ezhova T.S., Antonov M.V., Belov S.A. Case of abnormal course of kidney transplantation. Pacific Medical Journal. 2025;(1):82-85. (In Russ.) https://doi.org/10.34215/1609-1175-2025-1-82-85





































