Перейти к:
Микрофлора ран и резистентность к антибиотикам у пострадавших с термической травмой
https://doi.org/10.34215/1609-1175-2023-1-81-85
Аннотация
Цель: Изучение этиологической структуры микрофлоры ран и ее чувствительности к антибактериальным препаратам у пострадавших с термическими ожогами в специализированных отделениях для пациентов с термической травмой.
Материал и методы. Анализированы результаты микробиологических исследований 2354 проб отделяемого раневой поверхности 1581 пострадавшего с тяжелыми термическими ожогами, лечившихся в ожоговом отделении и в отделении анестезиологии, реанимации и интенсивной терапии Центра экстренной медицинской помощи Республики Саха (Якутия) в период с 2016 по 2020 г. Обработка данных и анализ антибиотикорезистентности выполнены на онлайн-платформе AMRcloud (версия: Beta, 05.07.2022).
Результаты. Выявлено, что в ожоговых ранах среди выделенных возбудителей доля Staphylococcus aureus составила 26,1%, Enterococcus faecalis – 24,5%, Pseudomonas aeruginosa – 11,9%, Klebsiella pneumonia – 9,4%, Acinetobacter baumannii – 7,9% и Escherichia coli – 6,0%. Установлена чувствительность выделенных штаммов микроорганизмов к карбапенемам и высокая резистентность к цефалоспоринам и фторхинолонам.
Заключение. Микробные штаммы, выявленные у пациентов с термическими ожогами, свидетельствует об инфицировании ран представителями внутрибольничной микрофлоры и их высокой резистентности к часто используемым антибиотикам.
Ключевые слова
Для цитирования:
Потапов А.Ф., Шамаева С.Х., Иванова А.А., Семенова С.В. Микрофлора ран и резистентность к антибиотикам у пострадавших с термической травмой. Тихоокеанский медицинский журнал. 2023;(1):81-85. https://doi.org/10.34215/1609-1175-2023-1-81-85
For citation:
Potapov A.F., Shamaeva S.H., Ivanova A.A., Semenova S.V. Wound microflora and antibiotic resistance in burn patients. Pacific Medical Journal. 2023;(1):81-85. (In Russ.) https://doi.org/10.34215/1609-1175-2023-1-81-85
Термические ожоги являются тяжелой травмой, характеризуются высоким уровнем летальности и инвалидизации пострадавших. По данным Всемирной организации здравоохранения, в мире ежегодно происходят 180 000 смертей в результате ожогов [1]. В России, по данным Федеральной службы государственной статистики, в 2020 г. зарегистрировано 211 200 обращений по поводу термических и химических ожогов, или 144,2 случая на 100 000 населения [2].
При обширных и глубоких ожогах присоединение и генерализация инфекции является основной причиной смерти пациентов [3][4]. При тяжелой ожоговой болезни на 7–14-е сутки после травмы наблюдается колонизация ран микроорганизмами, ее диссеминация и развитие ожоговой септикотоксемии [5][6]. В этот период важным компонентом лечения становится антибактериальная терапия. При этом неправильное назначение антибиотиков может способствовать развитию резистентности к антибиотикам, ускорять развитие мультирезистентных микробов, а также негативно влиять на экосистему отделения интенсивной терапии [7]. Поэтому решающее значение в выборе противомикробного препарата имеют результаты микробиологического исследования и данные локальной антибиотикорезистентности [8][9][10].
Цель исследования – изучение этиологической структуры микробиоты ран и ее чувствительности к антибактериальным препаратам у пострадавших с термическими ожогами в специализированных отделениях для пациентов с термической травмой.
Материалы и методы
Проведен анализ результатов микробиологических исследований 2354 проб отделяемого раневой поверхности у 1581 пострадавшего с тяжелыми термическими ожогами, лечившихся в ожоговом отделении и в отделении анестезиологии, реанимации и интенсивной терапии № 1 (ОАРИТ № 1) государственного бюджетного учреждения Республики Саха (Якутия) «Республиканская больница № 2 – Центр экстренной медицинской помощи (ГБУ РС(Я) «РБ № 2-ЦЭМП») в период с 2016 по 2020 г.
Исследование проводилось у пострадавших с ожоговой болезнью, которая развилась вследствие ожогов II–III степени и площадью поражения кожных покровов более 10% поверхности тела. Средняя длительность пребывания пациентов в ОАРИТ № 1 составила 5,1 ± 2,3 койко-дня, всего в ожоговом отделении – 53,3 ± 21,3 койко-дня.
Клинические категории чувствительности изолятов к антимикробным препаратам (АМП) определяли на основании пограничных значений, установленных Европейским комитетом по определению чувствительности к антимикробным препаратам (EUCAST).
Идентификацию вида микроорганизмов и определение чувствительности к АМП проводили на автоматическом анализаторе Phoenix (BD, США). Для определения продукции бета-лактамазы расширенного спектра (БЛРС) использовали «метод двойных дисков».
Обработка данных и анализ антибиотикорезистентности выполнены на онлайн-платформе AMRcloud (версия Beta, 05.07.2022).
Результаты исследования
За анализируемый период из 2354 исследуемых проб количество проб с ростом составило 1444 (61,4%), без роста – 910 (38,6%). Всего выделено 1773 микроорганизма, которые встречались в виде монокультуры в 1182 (81,8%) пробах, в составе 2-компонентных ассоциаций – в 197 (13,6%), 3-компонентных – в 63 (4,3%) и 4-компонентных – в 2 (0,3%) пробах.
Исследования показали, что спектр микроорганизмов, выделенных с раневой поверхности пациентов с термическими ожогами, характеризуется полиэтиологичностью, где удельный вес стафилококков составил 26,1%, энтерококков – 27,4%, грамотрицательных неферментирующих бактерий – 24,7% и энтеробактерий – 21,6% (табл. 1).
Таблица 1
Группы микроорганизмов, выделенные у больных с термической травмой
Группы | Количество | |
n | % | |
Staphylococcus spp. | 463 | 26,1 |
Enterococcus spp. | 486 | 27,4 |
Грам(-)неферментирующие бактерии | 439 | 24,7 |
Enterobacterales | 383 | 21,6 |
В структуре выделенных возбудителей доля Staphylococcus aureus составила 26,1% (n = 463), Enterococcus faecalis – 24,5% (n = 435), Pseudomonas aeruginosa – 11,9% (n = 212), Klebsiella pneumonia – 9,4% (n = 168), Acinetobacter baumannii – 7,9% (n = 141), Escherichia coli – 6,0% (n = 107). Доля остальных возбудителей составила менее 5% и представлена Acinetobacter spp., Proteus mirabilis, Enterococcusfaecium и Enterobacter spp. (рис. 1).
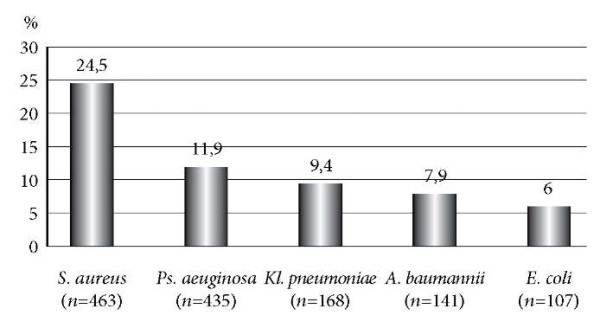
Рис. 1. Виды микроорганизмов, выделенных у больных с термическими ожогами (%).
Анализ динамики структуры возбудителей за период 2016–2020 гг. показал, что заметно изменился удельный вес Staphylococcus aureus – снизился с 31,1 до 14,4% и Acinetobacter baumannii – повысился с4,5 до 16%. Удельный вес других возбудителей варьировал (рис. 2).
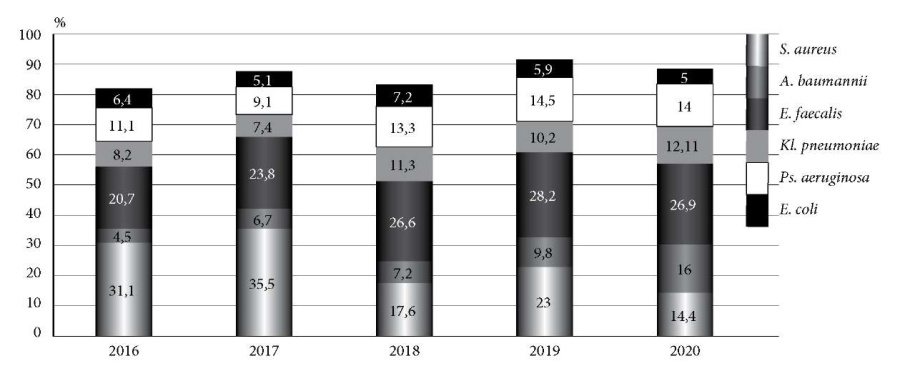
Рис. 2. Динамика этиологической структуры выделенных возбудителей за 2016–2020 гг. (%).
Изучение чувствительности наиболее значимых микроорганизмов показало следующее. Сохраняется высокая чувствительность Staphylococcus aureus к клиндамицину – 100% (n = 448) и линезолиду – 100% (n = 463), рифампицину – 98,3% (n = 405). Резистентность к остальным антибактериальным препаратам составила от 44,2% и выше (рис. 3).
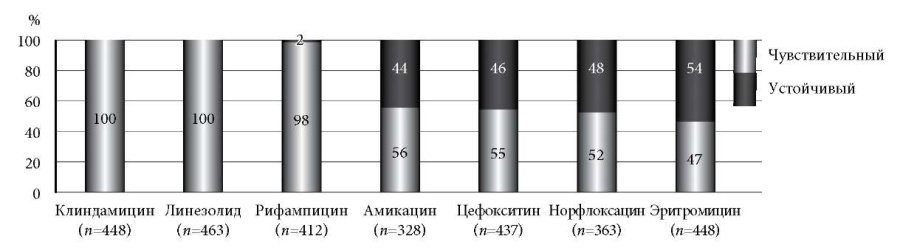
Рис. 3. Чувствительность Staphylococcus aureus к антибактериальным препаратам (%).
При этом за 2016–2020 гг. доля метициллинрезистентных штаммов Staphylococcus aureus составила соответственно по годам: 61,3% (ДИ:53,62–68,63), 48% (ДИ:40,1–55,9), 15,2% (ДИ:8,24–26,52), 30% (ДИ:18,07–45,43) и 30% (ДИ:16,66–47,88).
Чувствительность к препаратам, обладающим активностью к Pseudomonas aeruginosa, крайне низка и составила к амикацину 42,1% (n = 88), меропенему 24,8% (n = 39). Резистентность к остальным антибиотикам была значима выше и составила к азтреонаму – 75,5% (n = 34), цефепиму – 74,3% (n = 145), цефтазидиму – 73,3% (n = 151), ципрофлоксацину – 78,5% (n = 132) и имипенему – 70,5%
(n = 141) (рис. 4).
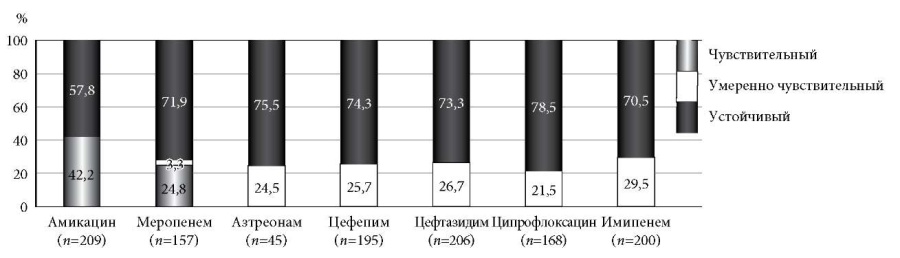
Рис. 4. Чувствительность Pseudomonas aeruginosa к антибактериальным препаратам (%).
Изучение чувствительности Klebsiella pneumoniae к антибиотикам показало ее чувствительность к имипенему, амикацину и меропенему соответственно у 83,3% (n = 40), 68,5% (n = 111) и 55,6% (n = 74) выделенных штаммов. Устойчивость изолятов к норфлоксацину составила 73,3% (n = 55), ципрофлоксацину – 86,3% (n = 57), цефалоспоринам (цефтриаксону, цефотаксиму, цефтазидиму, цефепиму) – на уровне 81,4–86,6%, амоксициллину-клавуланату – 89,7% (n = 148) (рис. 5).
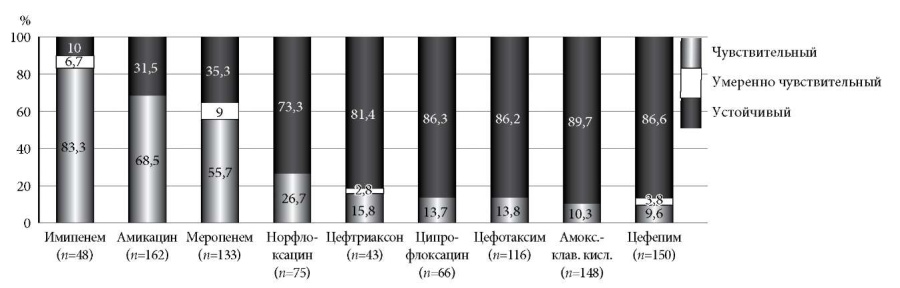
Рис. 5. Чувствительность Klebsiella pneumoniae к антибактериальным препаратам (%).
Высокий уровень резистентности к цефалоспоринам 3–4-го поколения был обусловлен продукцией БЛРС, который выявлялся за изучаемый период в 58,4–78,6% случаев.
Чувствительность Acinetobacter baumannii к имипенему, меропенему и амикацину выявлена соответственно у 63,4% (n = 80), 47,3% (n = 54) и 35,7% (n = 49) штаммов. Устойчивость к ципрофлоксацину составила 83,1% (n = 89) (рис. 6).
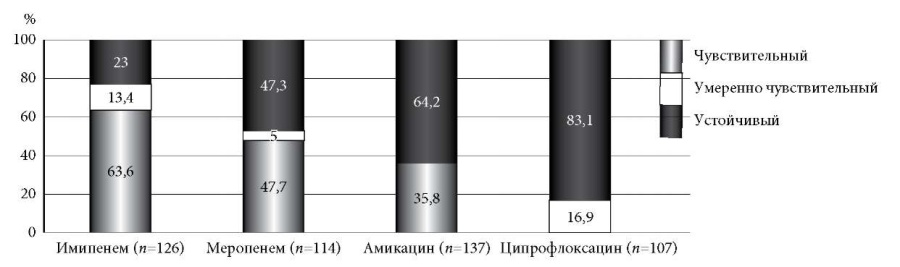
Рис. 6. Чувствительность Acinetobacter baumannii к антибактериальным препаратам (%).
Чувствительность выделенных штаммов Escherichia coli к имипенему составила 96,4% (n = 27), меропенему – 78,8% (n = 67) и амикацину – 69,6% (n = 71). Устойчивость к фторхинолонам, цефалоспоринам и амоксициллину-клавуланату превышала 60%. Заметим, что 58,7% выделенных штаммов Escherichia coli являлись продуцентами БЛРС.
Обсуждение полученных данных
Представленный в нашем исследовании микробный спектр ожоговых ран свидетельствует об инфицировании представителями внутрибольничной микробиоты стафилококками, неферментирующими грамотрицательными бактериями и энтеробактериями. Указанные микроорганизмы характерны для многих ожоговых центров, и полученные результаты не противоречат данным других исследований [4][6–9].
В структуре микроорганизмов сохраняется доминирующая роль Enterococcus faecalis, удельный вес которого в динамике не меняется. Среди негативных тенденций отмечается рост доли Acinetobacter baumannii, утрата эффективности антибиотиков, активных в отношении Pseudomonas aeruginosa, а также фторхинолонов и цефалоспоринов в лечении Klebsiella pneumoniae и Escherichia coli.
Проведенное исследование указывает на необходимость дальнейшего микробиологического мониторинга возбудителей инфекции у больных с ожоговой болезнью и выявления механизмов резистентности к АМП.
Заключение
Полученные данные свидетельствуют об инфицировании ран у пациентов с термическими ожогами в основном представителями внутрибольничной микрофлоры, которые обладают высокой устойчивостью к большинству используемых антибактериальных препаратов. Микробиологический мониторинг и определение механизмов резистентности у ожоговых пациентов позволяют выявлять их локальные особенности и оптимизировать антибактериальную терапию.
Конфликт интересов: авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Источник финансирования: авторы заявляют о финансировании работы из собственных средств.
Участие авторов:
Концепция и дизайн исследования – АФП, СХШ.
Сбор и обработка материала – АФП, СХШ.
Статистическая обработка – АФП, СХШ.
Написание текста – АФП, СХШ, ИАА, СВС
Редактирование – ИАА
Список литературы
1. World Health Organization. Burns, 2018. URL:https://www.who.int/news-room/fact-sheets/detail/burns (Accessed Dec. 6, 2022).
2. Федеральная служба государственной статистики. Здравоохранение в России – 2021 г. https://gks.ru/bgd/regl/b21_34/Main.htm (дата обращения/access date: 06.12.2022).
3. Zavlin D, Chegireddy V, Boukovalas S, Nia AM, Branski LK, Friedman JD, Echo A. Multiinstitutional analysis of independent predictors for burn mortality in the United States. Burns Trauma. 2018;22(6):24. https://doi.org/10.1186/s41038-018-0127-y
4. Барсук А.Л., Ловцова Л.В., Некаева Е.С., Сорокина Ю.А. Современное состояние и перспективы антибиотикопрофилактики у пациентов, перенесших ожоговую травму (обзор). Саратовский научно-медицинский журнал. 2019;15(1):108–13.
5. Клинические рекомендации. Ожоги термические и химические. Ожоги солнечные. Ожоги дыхательных путей. 2020. https://cr.minzdrav.gov.ru/recomend/687_1 (дата обращения: 06.12.2022).
6. Ladhani HA, Yowler CJ, Claridge JA. Burn Wound Colonization, Infection, and Sepsis. Surg Infect (Larchmt). 2021;22(1):44–8. doi: 10.1089/sur.2020.346
7. Tsolakidis S, Freytag DL, Dovern E, Alharbi Z, Kim B-S, Houschyar KS, Reumuth G, Schafer B, Rennekampff H-O, Pallua N, Grieb G. Infections in Burn Patients: A Retrospective View over Seven Years. Medicina. 2022;58:1066. doi: 10.3390/medicina58081066
8. Glik J, Labus W, Kitala D, Mikus-Zagorska K, Roberts CD, Nowak M, Kasperczyk A, Kawecki M. A 2000 patient retrospective assessment of a new strategy for burn wound management in view of infection prevention and treatment. Int Wound J. 2018;15(3):344–9. doi: 10.1111/iwj.12871
9. Сабирова Е.В., Гординская Н.А., Абрамова Н.В., Карасева Г.Н., Савочкина Ю.А. Микроэкология ожоговых стационаров. Клиническая лабораторная диагностика. 2017;62(5):310–2. doi: 10.18821/0869-2084-2017-62-5-310-312
10. Houschyar KS, Tapking C, Duscher D Wallner C, Sogorski A, Rein S, Pforringer D, Reumuth G, Weissenberg K, Grieb G, Branski LK, Siemers F, Behr B, Lehnhardt M. Antibiotic treatment of infections in burn patients – a systematic review. Handchir Mikrochir Plast Chir. 2019;51(2):111–8. doi: 10.1055/a-0802-8882
Об авторах
А. Ф. ПотаповРоссия
Потапов Александр Филиппович – д-р мед. наук, доцент, профессор кафедры анестезиологии, реаниматологии и интенсивной терапии с курсом скорой медицинской помощи факультета последипломного обучения врачей
677000, Республика Саха (Якутия), г. Якутск, ул. Ойунского, 27
С. Х. Шамаева
Россия
Якутск
А. А. Иванова
Россия
Якутск
С. В. Семенова
Россия
Якутск
Рецензия
Для цитирования:
Потапов А.Ф., Шамаева С.Х., Иванова А.А., Семенова С.В. Микрофлора ран и резистентность к антибиотикам у пострадавших с термической травмой. Тихоокеанский медицинский журнал. 2023;(1):81-85. https://doi.org/10.34215/1609-1175-2023-1-81-85
For citation:
Potapov A.F., Shamaeva S.H., Ivanova A.A., Semenova S.V. Wound microflora and antibiotic resistance in burn patients. Pacific Medical Journal. 2023;(1):81-85. (In Russ.) https://doi.org/10.34215/1609-1175-2023-1-81-85





































