Перейти к:
Возможности компьютерно-томографической денситоволюметрии в оценке динамики структурно-функциональных изменений в легких при саркоидозе органов дыхания
https://doi.org/10.34215/1609-1175-2023-3-39-44
Аннотация
Цель. Оценить динамику структурно-функциональных изменений в легких при саркоидозе органов дыхания методом компьютерно-томографической (КТ) денситоволюметрии с определением возможности прогнозирования течения заболевания.
Материалы и методы. Обследованы пациенты с диагнозом «саркоидоз органов дыхания» в исходной точке (n = 101) и по окончании наблюдения через год (n = 79). Функцию внешнего дыхания оценивали по данным спирометрии форсированного выдоха, бодиплетизмографии и исследования диффузионной способности и объемов легких. Всем обследованным выполнена двухэтапная КТ легких в инспираторную и экспираторную фазы с применением метода КТ-денситоволюметрии. Оценивали динамику количественных показателей структурно-функциональных изменений в легких.
Результаты. По истечении срока наблюдения у пациентов выявлена отрицательная, стабильная и положительная рентгенологическая динамика, характеризующаяся не только изменениями качественных признаков характерных для саркоидоза рентгенологических паттернов, но и количественными данными показателей КТ-денситоволюметрии. Использование показателя КТ-денситоволюметрии – инспираторного индекса обоих легких, показателей спирометрии – пиковой объемной скорости выдоха и отношения ОФВ1 к ЖЕЛ в % от должных значений – в качестве независимых предикторов способно с достаточно высокой для практических целей точностью обеспечить прогноз прогрессирующего течения саркоидоза органов дыхания в течение года.
Заключение. Показатели КТ-денситоволюметрии позволяют количественно оценить динамику структурно-функциональных изменений в легких и прогнозировать прогрессирующее течение саркоидоза органов дыхания с целью коррекции терапии.
Ключевые слова
Для цитирования:
Игнатьева Е.А. Возможности компьютерно-томографической денситоволюметрии в оценке динамики структурно-функциональных изменений в легких при саркоидозе органов дыхания. Тихоокеанский медицинский журнал. 2023;(3):39-44. https://doi.org/10.34215/1609-1175-2023-3-39-44
For citation:
Ignat’eva E.A. Possibilities of computed tomography densitovolumetry in assessing the dynamics of structural and functional changes in the lungs of patients with pulmonary sarcoidosis. Pacific Medical Journal. 2023;(3):39-44. (In Russ.) https://doi.org/10.34215/1609-1175-2023-3-39-44
Саркоидоз – системное воспалительное заболевание, патоморфологически характеризующееся образованием неказеозных гранулем в пораженных органах [1]. Легкие поражаются более чем у 90% пациентов [2][3]. Клиническая картина, течение и тяжесть саркоидоза вариабельны, что, в свою очередь, влияет на лечение и прогноз заболевания [1][4][5]. Для большинства пациентов саркоидоз органов дыхания (СОД) является доброкачественным, однако до 50% пациентов нуждаются в лечении, а у 10–30% пациентов развивается хроническое изнурительное заболевание, в некоторых случаях (5–30%) с выраженным легочным фиброзом и различной степенью дыхательной недостаточности [6].
Саркоидоз является диагнозом исключения без надежного биомаркера для мониторинга течения заболевания [7]. Для прогнозирования течения саркоидоза органов дыхания используют снижение ФЖЕЛ, признаки легочной гипертензии и легочного фиброза [8].
Определяющая роль в диагностике СОД на сегодня принадлежит медицинской визуализации и, в частности, компьютерной томографии (КТ). Данные КТисследований позволяют контролировать течение болезни и эффективность проводимой терапии [8], но результат визуального анализа изображений может сильно различаться даже у одинаково подготовленных специалистов лучевой диагностики, что мотивирует на поиск методов обработки цифровых изображений, которые позволили бы дать точные количественные характеристики выявленных изменений.
Цель работы: оценить динамику структурно-функциональных изменений в легких у больных саркоидозом органов дыхания методом КТ-денситоволюметрии с определением возможности прогнозирования течения заболевания.
Материалы и методы
В исследовании участвовал 101 пациент с диагнозом саркоидоз органов дыхания (69,3% женщин, 30,7% мужчин), средний возраст 46,8 ± 1,3 года. Критерии включения: мужчины и женщины в возрасте от 18 до 75 лет, диагноз СОД, установленный в соответствии с Международной классификацией болезней (МКБ-10), Федеральными клиническими рекомендациями [9], критериями WASOG [10], подписанное перед исследованием информированное согласие. Критерии исключения: бронхиальная астма, хронический обструктивный бронхит, активный туберкулез, рак легкого и другие заболевания органов дыхания в активной фазе, беременность, кормление грудью.
Исследование проведено с соблюдением требований Хельсинкской декларации (Этические принципы проведения медицинских исследований с участием человека в качестве субъекта, 2013), Федерального закона 323-ФЗ от 21 ноября 2011 г. «Об основах охраны здоровья граждан в Российской Федерации» (с изменениями от 25 июня 2012 г.) и одобрения Комитета по биомедицинской этике Дальневосточного научного центра физиологии и патологии дыхания (протокол №143 от 15 декабря 2020 г.).
По дизайну когортное наблюдательное проспективное исследование включало в себя исходно и через год: оценку вентиляционной функции легких методом спирометрии (Easy on-PC; nddMedizintechnik AG, Швейцария) с анализом параметров поток-объем форсированного выдоха (ОФВ1, ФЖЕЛ, ПОС, ОФВ1/ ЖЕЛ, МОС75, СОС25–75); оценку воздухонаполненности легких методом общей плетизмографии (Power Cube BODY+; Гансхорн, Германия) с определением общей емкости легких (ОЕЛ), остаточного объема легких (ООЛ); исследование общей (DLCO) и удельной (KCO) диффузионной способности легких по СО методом одиночного вдоха (CO-Diffusion, Гансхорн, Германия). Условия проведения функциональных исследований были соблюдены в соответствии с требованиями [11].
Двухэтапную КТ органов грудной клетки выполняли на сканерах Canon Aquilion Lightning 160 и Activion 16 (Toshiba, Япония) на уровне максимального вдоха и выдоха, с последующей трехмерной реконструкцией. С помощью программного обеспечения Vitrea Lung Density Analysis с автоматической сегментацией анализировали полученные изображения [12]. Для количественной оценки использовали предложенный нами ранее трехуровневый денситометрический диапазон: от -850 HU и ниже (верхний диапазон плотности, соответствующий плотности воздуха); от -850 HU до -650 HU (средний диапазон плотности, соответствующий плотности нормальной легочной ткани) и от -650 до 0 HU (нижний диапазон плотности, соответствующий плотности измененной, слабоаэрируемой легочной ткани) [12].
Оценивали объемные параметры, полученные методом автоматической денситоволюметрии (в мл): объем в верхнем диапазоне плотности в инспираторную фазу дыхания – суммарная инспираторная воздухонаполненность обоих легких (ИВ2); объем в среднем диапазоне плотности в инспираторную фазу в обоих легких (ИС2); объем в нижнем диапазоне плотности в инспираторную фазу в обоих легких (ИН2); инспираторный индекс обоих легких (ИИ2), рассчитанный как ИВ2/(ИВ2 + ИС2); объем в верхнем диапазоне плотности в экспираторную фазу дыхания – суммарная экспираторная воздухонаполненность обоих легких (ЭВ2) [12].
Статистическую обработку проводили с помощью стандартных методов вариационной статистики с использованием программы «Автоматизированная система диспансеризации» [13]. Для представления выборки с нормальным распределением использовали среднее значение (М) и стандартную ошибку среднего (m) (M ± m), для выборок с распределением, отличным от нормального – медиану и интерквартильный размах (Me (Q1; Q3)). При нормальном типе распределения использовали непарный и парный t-критерий Стьюдента, при распределении данных, отличном от нормального, применяли критерии Колмогорова – Смирнова и Манна – Уитни, парный критерий Уилкоксона. Для всех величин значение р менее 0,05 считалось значимым. Для построения прогностической модели использован множественный пошаговый дискриминантный анализ.
Результаты исследования
Согласно классификации J.G. Scadding [14], стадия 0 определена у троих участников исследования (3%), стадия I у восьми (8%), стадия II у пятидесяти (49%), стадия III у тридцати трех (33%) и стадия IV – у семи (7%) пациентов. Из 79 пациентов, обследованных через год, 30% (24 человека) получали лечение глюкокортикостероидами, а 56% (44) принимали витамин Е и пентоксифиллин в сочетании или в виде монотерапии.
При оценке показателей спирометрии в общей группе пациентов с саркоидозом наблюдалась высокая вариабельность параметров, при этом средние значения по группе были в границах нормы (табл. 1).
Таблица 1
Показатели функции внешнего дыхания у больных СОД в динамике
Показатель | Исходные данные | Через год | Значимость различий |
ФЖЕЛ (% долж.) | 101,2 ± 2,6 | 103,8 ± 1,6 | p = 0,2012 |
ОФВ1 (% долж.) | 100,7 ± 2,0 | 99,1 ± 1,9 | p = 0,1979 |
ОФВ1/ЖЕЛ (%) | 99,0 ± 0,9 | 98,8 ± 0,9 | p = 0,7642 |
ПОС (% долж.) | 103,7 ± 2,2 | 99,8 ± 2,2 | p = 0,0485 |
МОС50 (% долж.) | 91,4 ± 5,9 | 89,4 ± 3,3 | p = 0,7486 |
МОС75 (% долж.) | 70.2 ± 3.4 | 70.0 ± 3,4 | p = 0,9505 |
СОС25-75(% долж.) | 86,9 ± 3,6 | 83,1 ± 3,3 | p = 0,2176 |
ООЛ (% долж.) | 117,5 [ 98,0; 150,0] | 108,5 [ 89,0; 130,0] | p = 0,1451 |
ОЕЛ (% долж.) | 109,0 [ 95,0; 123,0] | 108,0 [ 98,0; 119,0] | p = 0,5942 |
ООЛ/ОЕЛ (% долж.) | 109,0 [ 94.0; 126.0] | 101,0 [ 82,0; 193,0] | p = 0,0412 |
DLCO (%) | 97,0 [ 85,0; 106,0] | 94,0 [ 86,0; 108,0] | p = 0,2718 |
KCO (%) | 103,0 [ 93,5; 117,0] | 104,0 [ 90,0; 114,0] | p = 0,6714 |
В то же время по основным показателям КТденситоволюметрии в общей группе пациентов с СОД отмечалась достоверная динамика (табл. 2). Установлен статистически значимый прирост показателей воздухонаполненности как в инспираторную (ИВ2), так и в экспираторную фазу дыхания (ЭВ2).
Таблица 2
Показатели КТ-денситоволюметрии больных СОД в динамике
Показатель | Исходные данные | Через год | Значимость различий |
ИВ2 (мл) | 3456,0 ± 135,6 | 3838,2 ± 151,9 | p = 0,0001 |
ЭВ2 (мл) | 85,0 [ 16,5;224,0] | 199,0 [ 60,0;491,0] | р < 0,0001 |
ИИ2 | 0,7 ± 0,02 | 0,8 ± 0,01 | р < 0,0001 |
ИС2 (мл) | 1199,7 ± 63,2 | 786,4 ± 44,6 | р < 0,0001 |
ИН2 (мл) | 326,4 ± 14,7 | 299,6 ± 11,9 | p = 0,0029 |
При корреляционном анализе в общей группе пациентов СОД установлено наличие достоверных связей ряда показателей КТ-денситоволюметрии с параметрами проходимости бронхов. Так, ИВ2 в начале наблюдения с высокой достоверностью коррелировал с ФЖЕЛ (r = 0,39; p = 0,0002), ОФВ1 (r = 0,38; p = 0,0003), ПОС (r = 0,36; p = 0,0005), через год наблюдалось усиление его связей с ФЖЕЛ (r = 0,48; p < 0,0001) и ОФВ1 (r = 0,44; p = 0,0002). Достоверная отрицательная связь была определена между исходными значениями ЭВ2 и ОФВ1/ЖЕЛ (RS = -0,45; p < 0,0001), СOC25-75 (RS = -0,39; p = 0,0002), спустя год наблюдения эти связи не определялись. В начале наблюдения были зафиксированы отрицательные взаимосвязи КТ-показателей ИС2, ИН2 с ОФВ1 (r = -0,33; p = 0,0016; r = -0,45; p < 0,0001, соответственно), через год наблюдалось усиление этих связей. ИИ2 в начале исследования положительно коррелировал с ФЖЕЛ (r = 0,51; p < 0,0001), в конце наблюдения добавилась его взаимосвязь с ОФВ1 (r = 0,52; p < 0,0001).
Ретроспективно пациенты были разделены на три группы в зависимости от особенностей течения болезни на протяжении года наблюдения: группа А (15 человек) – с отрицательной рентгенологической картиной через год, проявлявшейся увеличением внутригрудных лимфатических узлов более 5 мм по малому вектору и увеличением объема характерных для саркоидоза изменений в легких), группа Б (39 человек) – со стабильной рентгенологической картиной, группа С (25 человек) – с положительной рентгенологической динамикой, проявлявшейся уменьшением размеров внутригрудных лимфатических узлов по малому вектору более чем на 5 мм и уменьшением объема патологических изменений в паренхиме легких.
При сравнении в динамике данных спирометрии в группе А определено достоверное снижение ОФВ1 (рис. 1). Его величина стала статистически значимо меньше, чем в группе Б (91,7 ± 5,7 и 102,1 ± 1,8%, соответственно, p = 0,0265). Величина ФЖЕЛ в группах А и Б к концу наблюдения также статистически значимо различалась (94,9 ± 6,1 и 107,1 ± 2,5%, соответственно, p = 0,0309). В группе Б в динамике наблюдалось статистически значимое снижение ПОС. В группе С статистически значимо не изменился ни один из показателей спирометрии.
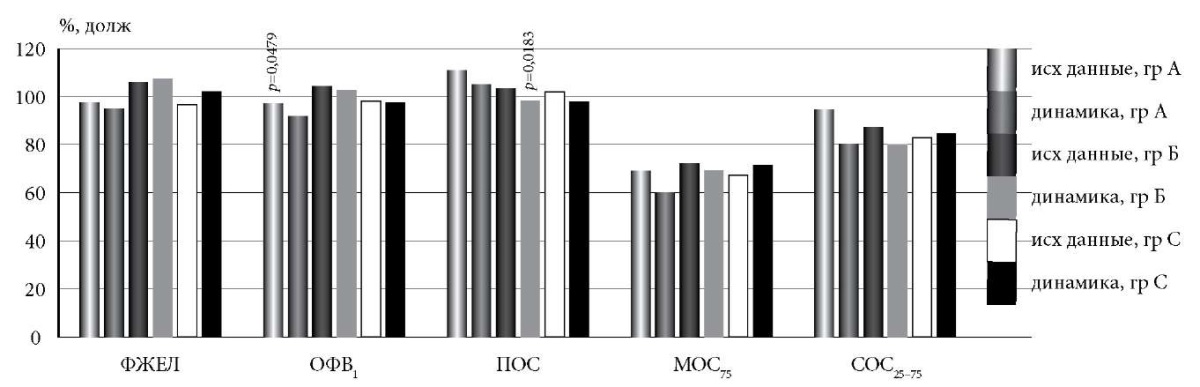
Рис. 1. Показатели спирометрии в динамике у пациентов с СОД.
Здесь и далее: p – уровень значимости различий показателя
между исходными данными и через год (парный метод).
Показатели бодиплетизмографии во всех трех группах оставались достаточно стабильными на протяжении года. При этом в группах А и Б к концу наблюдения определена значимая межгрупповая разница ОЕЛ (89,9 ± 6,5 и 114,5 ± 3,0% соответственно, p=0,0079) и ООЛ (84,2 ± 11,5 и 124,5 ± 9,4% соответственно, р = 0,0358).
Параметры общей (DLCO) и удельной (KCO) диффузионной способности легких исходно и через год в группе А достоверно не изменялись. DLCO составил 90,5 [ 76,5; 107,0] и 88,9 [ 78,0; 97,5]% соответственно, (p = 0,6356); KCO 96,0 [ 84,0; 120,0] и 96,0 [ 87,5; 112,0]% соответственно (p = 0,4413). В группе В DLCO составил 102,0 [ 93,0; 111,0] и 99,5 [ 91,5; 112,5]% (p = 0,7156); KCO 105,0 [ 99,0; 118,5] и 107,0 [ 98,5; 114,0]% (p = 0,2326). В группе С DLCO составил 86,0 [ 81,0; 101,0] и 91,0 [ 83,5; 101,5]% (p = 0,0980); КСО 96,0 [ 85,0; 111,0] и 91,0 [ 83,5; 101,5]% (p = 0,4603).
При анализе КТ-денситоволюметрических показателей в динамике в группе А определено статистически значимое уменьшение ИС2, ЭВ2 (рис. 2). Показатель ИИ2 в группе А достоверно увеличился с 0,6 ± 0,04 до 0,7 ± 0,03 (p = 0,0007). В группе Б через год отмечено увеличение ИВ2, ЭВ2, тогда как ИС2 и ИН2 достоверно снижались (рис. 2), а ИИ2 увеличивался с 0,7 ± 0,04 до 0,8 ± 0,001 (p = 0,0011). Анализ динамики параметров КТ-денситоволюметрии в группе С показал статистически значимое увеличение ИВ2, ЭВ2 и снижение ИС2, ИН2 (рис. 2). Показатель ИИ2 увеличивался с 0,7 ± 0,03 до 0,8 ± 0,02 (p = 0,0063).
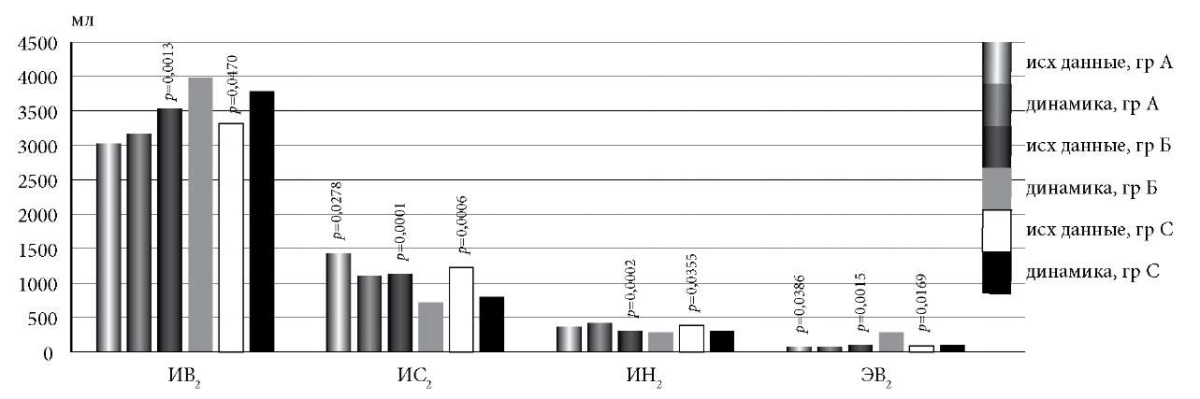
Рис. 2. Показатели КТ-денситоволюметрии в динамике у пациентов с СОД.
По окончании наблюдения определена межгрупповая статистически значимая разница значений показателей КТ-денситоволюметрии между группами А и Б: ИВ2 (3171,3 ± 296,7 и 3983,9 ± 212,4 мл, p = 0,0429), ИС2 (1099,9 ± 117,4 и 711,0 ± 49,9 мл, p = 0,0008), ИН2 (418,5 ± 41,7 и 280,7 ± 12,4 мл, p = 0,0001), ИИ2 (0,73 ± 0,03 и 0,84 ± 0,01, p = 0,0008); между группами А и С: ИС2 (1099,9 ± 117,4 и 801,1 ± 76,3 мл, p = 0,0322), ИН2 (418,5 ± 41,7 и 299,4 ± 41,7 мл, p = 0,007).
Наличие статистически достоверных различий, а также корреляционных связей между группами, сформированными на основании качественных данных КТ, дало основание предполагать возможность прогнозирования течения СОД.
С целью прогнозирования течения заболевания, ретроспективно, по исходным данным пациенты с положительной рентгенологической динамикой и стабильной рентгенологической картиной были объединены в одну группу, вторую группу составили пациенты с отрицательной рентгенологической динамикой. Из всей совокупности изученных параметров были выбраны переменные, которые наилучшим образом способны прогнозировать у этих пациентов ухудшение течения болезни. Путем применения пошагового дискриминантного анализа построено дискриминантное уравнение, включающее спирометрические и денситометрические параметры: пиковую объемную скорость форсированного выдоха (ПОС, в % от должного), отношение ОФВ1/ЖЕЛ (в % от должного) и ИИ2, рассчитанный по формуле ИИ2 = ИВ2/(ИВ2 + ИС2).
Построенное дискриминантное уравнение имеет вид:
D = –0,370 × ОФВ1/ЖЕЛ (%, долж) –
– 0,263 × ПОС (%, долж) + 42,642 × ИИ2,
где D – дискриминантная функция с граничным значением, равным -53,54.
При D меньше граничного значения дискриминантной функции прогнозируют прогрессирующее течение саркоидоза органов дыхания. Вероятность ошибочного прогноза, рассчитанная при помощи автоматизированной системы для научных исследований в области физиологии и патологии дыхания человека, составляет 0,6% [13].
Обсуждение полученных данных
Оценивая результаты проведенного исследования, следует подчеркнуть, что относительно благоприятное течение саркоидоза органов дыхания с улучшением показателей в годичной динамике регистрировалось лишь у 31,6% пациентов, стабильное течение наблюдалось в 49,4% случаев. По нашим данным, ухудшение наступило в 19% случаев, что могло быть связано с неэффективностью проводимой терапии, ее недостаточностью или отсутствием мотивации применения. Так, анкетирование пациентов с использованием вопросника потенциальной приверженности лечению КОП-25п [15] показало, что 29% больных не заинтересованы в постоянном использовании препаратов и имеют низкую мотивацию.
У пациентов СОД в общей группе показатель КТденситоволюметрии, характеризующий воздухонаполненность легких на вдохе (исходный и через год), имел положительные корреляционные взаимосвязи с показателями бронхиальной проходимости и воздухонаполненности, определенными методом спирометрии, что свидетельствовало о возможности использования его в качестве маркера нарушений вентиляционной функции легких. Показатель, характеризующий воздухонаполненность легких на выдохе, был обратно зависим от проходимости дыхательных путей как на уровне проксимальных, так и дистальных бронхов. К концу наблюдения отмечалось усиление отрицательных взаимосвязей спирометрических показателей бронхиальной проходимости с инспираторными показателями объемов в среднем и нижнем диапазонах плотности. Это объясняется тем, что уменьшение объема структурных изменений в легких привело к улучшению вентиляционной функции.
Стратификация пациентов по качественным рентгенологическим признакам позволила выявить значимую межгрупповую разницу между показателями в динамике, отражающими как структурные, так и функциональные изменения в легких.
Различные варианты развития болезни у конкретных пациентов диктуют насущную потребность в прогнозировании течения СОД. Метод КТденситоволюметрии количественно отражает изменения объемов в легких в выбранных денситометрических диапазонах, не противореча данным качественного анализа КТ-изображений, способен выявлять динамические структурно-функциональные изменения даже в случаях, когда качественная оценка КТ-данных и функциональные тесты значимых изменений не фиксируют; метод лишен субъективизма со стороны исследователя, поскольку результатом его являются конкретные количественные данные. КТ-денситоволюметрия может стать реальной альтернативой или дополнительным инструментом для исследования функции легких у пациентов с СОД. Предложенный способ прогнозирования прогрессирующего течения СОД на основании показателей КТ-денситоволюметрии обеспечивает необходимую персонификацию стратегии лечения болезни. Его внедрение в клиническую практику требует дальнейших проспективных и контролируемых исследований.
Заключение
Показатели КТ-денситоволюметрии позволяют количественно оценить динамику структурнофункциональных изменений в легких у пациентов с саркоидозом органов дыхания и прогнозировать прогрессирующее течение болезни. В протоколах КТисследований помимо стандартного описания качественных характеристик выявленных изменений необходимо указывать значения основных показателей КТ-денситоволюметрии. При этом ИВ2 и ЭВ2 отражают наличие функциональных изменений, а ИС2 и ИН2 характеризуют объем измененной структуры легких. Эти показатели позволяют определить степень тяжести нарушений и провести их количественную оценку в динамике для дальнейшей коррекции тактики лечения. Режим диспансерного наблюдения за пациентами с саркоидозом определяется лечащим врачом в индивидуальном порядке и зависит от течения заболевания, объема поражения и наличия осложнений. КТ-исследование с применением денситоволюметрии целесообразно проводить при первичном обращении и ежегодно при дальнейшем наблюдении пациента для возможности прогнозирования прогрессирующего течения болезни.
Конфликт интересов: автор декларирует отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Источник финансирования: работа выполнена в рамках выполнения государственного задания Минобрнауки России по теме 0420-2020-0001.
Список литературы
1. Crouser ED, Maier LA, Wilson KC, Bonham CA, Morgenthau AS, Patterson KC, et al. Diagnosis and detection of sarcoidosis. An official American thoracic society clinical practice guideline. Am J Respir Crit Care Med. 2020;201:e26–51. doi: 10.1164/rccm.202002-0251ST
2. Baughman RP, Teirstein AS, Judson MA, Rossman MD, Yeager H, Bresnitz EA, et al. Clinical characteristics of patients in a case control study of sarcoidosis. Am J Respir Crit Care Med. 2001;164:1885–9. doi: 10.1164/ajrccm.164.10.2104046
3. Zhou Y, Gerke AK, Lower EE, Vizel A, Talwar D, Strambu I, et al. The impact of demographic disparities in the presentation of sarcoidosis: a multicenter prospective study. Respir Med. 2021;187:106564. doi: 10.1016/j.rmed.2021.106564
4. Baughman RP, Scholand MB, Rahaghi FF. Clinical phenotyping: role in treatment decisions in sarcoidosis. Eur Respir Rev. 2020;29:190145. doi: 10.1183/16000617.0145-2019
5. Baughman RP, Valeyre D, Korsten P, Mathioudakis AG, Wuyts WA, Wells A, et al. ERS clinical practice guidelines on treatment of sarcoidosis. Eur Respir J. 2021;58:2004079. doi: 10.1183/13993003.04079-2020
6. Judson MA, Baughman RP, Thompson BW, Teirstein AS, Terrin ML, Rossman MD, et al. Two year prognosis of sarcoidosis: the ACCESS experience. Sarcoidosis Vasc Diffuse Lung Dis. 2003;20:204–11.
7. Morgenthau AS, Iannuzzi MC. Recent advances in sarcoidosis. Chest. 2011;139(1):174–82. doi: 10.1378/chest.10-0188
8. Терпигорев С.А., Ильченко В.А. Прогностический алгоритм течения саркоидоза легких и внутригрудных лимфоузлов. Альманах клинической медицины. 2014;35:42–8 doi: 10.18786/2072-0505-2014-35-42-48
9. Визель А.А., Визель И.Ю. Саркоидоз: основные положения проекта федеральных клинических рекомендаций. Терапия. 2019;5:20–6 doi: 10.18565/therapy.2019.5.20-26
10. Statement on sarcoidosis. Joint Statement of the American Thoracic Society (ATS), the European Respiratory Society (ERS) and the World Association of Sarcoidosis and Other Granulomatous Disorders (WASOG) adopted by the ATS Board of Directors and by the ERS Executive Committee, February 1999. Am J Respir Crit Care Med. 1999;160(2):736–55. doi: 10.1164/ajrccm.160.2.ats4-99
11. Функциональная диагностика: национальное руководство / под ред. Н.Ф. Берестень, В.А. Сандрикова, С.И. Федоровой. М.: ГЭОТАР-Медиа. 2019; 784.
12. Игнатьева Е.А., Ильин А.В., Перельман Ю.М. Диагностика легочного саркоидоза методом компьютерно-томографической денситоволюметрии. Бюллетень физиологии и патологии дыхания. 2022; 1(84): 49–62. doi: 10.36604/1998-5029-2022-84-49-62
13. Ульянычев Н.В. Системность научных исследований в медицине. Saarbrücken: LAP LAMBERT. 2014: 140
14. Scadding JG. Prognosis of intrathoracic sarcoidosis in England. A review of 136 cases after five years' observation. Br Med J. 1961;2(5261):1165–72. doi: 10.1136/bmj.2.5261.1165
15. Николаев Н.А., Скирденко Ю.П. Российский универсальный опросник количественной оценки приверженности к лечению (КОП-25). Клиническая фармакология и терапия. 2018; 27(1):74–8
Об авторе
Е. А. ИгнатьеваРоссия
Игнатьева Елена Александровна – врач-рентгенолог отделения лучевой диагностики клиники ДНЦ ФПД, аспирант, лаборатория функциональных методов исследования дыхательной системы
675000, г. Благовещенск, ул. Калинина, 22
Рецензия
Для цитирования:
Игнатьева Е.А. Возможности компьютерно-томографической денситоволюметрии в оценке динамики структурно-функциональных изменений в легких при саркоидозе органов дыхания. Тихоокеанский медицинский журнал. 2023;(3):39-44. https://doi.org/10.34215/1609-1175-2023-3-39-44
For citation:
Ignat’eva E.A. Possibilities of computed tomography densitovolumetry in assessing the dynamics of structural and functional changes in the lungs of patients with pulmonary sarcoidosis. Pacific Medical Journal. 2023;(3):39-44. (In Russ.) https://doi.org/10.34215/1609-1175-2023-3-39-44





































