Перейти к:
Инновационные разработки в рамках междисциплинарных исследований: препараты для радио- и фотодинамической терапии
https://doi.org/10.34215/1609-1175-2024-2-5-9
Аннотация
Широкое применение перспективного метода терапевтического сочетанного воздействия световых волн и чувствительных к ним соединений-фотосенсибилизаторов (ФС) на опухолевые клетки ограничено глубиной проникновения волн инфракрасного диапазона в ткани организма и неидеальностью свойств применяемых в медицинской практике препаратов. Активация ФС электромагнитными волнами позволяет проводить неинвазивное лечение глубоко расположенных опухолей. Причем сочетание традиционной радио- и фотодинамической терапий (ФДТ) потенциально способно снизить токсическое действие на нормальные ткани при сохранении эффективности этих методов. На сегодня механизм действия радиофотодинамической терапии (РФДТ), экспериментальные модели, а также протоколы ее проведения остаются малоизученными. В рамках настоящего обзора представлены краткие сведения о развитии метода РФДТ, а также основные научные достижения в этой области, в том числе являющиеся достижениями совместной работы ученых Тихоокеанского государственного медицинского университета и Института химии Дальневосточного отделения РАН, поддерживаемые программой стратегического академического лидерства «Приоритет-2030».
Ключевые слова
Для цитирования:
Шуматов В.Б., Шевченко О.В., Плехова Н.Г., Апанасевич В.И., Медков М.А., Стеблевская Н.И., Транковская Л.В., Лебедев С.В. Инновационные разработки в рамках междисциплинарных исследований: препараты для радио- и фотодинамической терапии. Тихоокеанский медицинский журнал. 2024;(2):5-9. https://doi.org/10.34215/1609-1175-2024-2-5-9
For citation:
Shumatov V.B., Shevchenko O.V., Plekhova N.G., Apanasevich V.I., Medkov M.A., Steblevskaya N.I., Trankovskaya L.V., Lebedev S.V. Innovative developments in the framework of interdisciplinary research: Drugs for radio- and photodynamic therapy. Pacific Medical Journal. 2024;(2):5-9. (In Russ.) https://doi.org/10.34215/1609-1175-2024-2-5-9
Впервые технология терапевтического сочетанного воздействия энергии световых волн, чувствительных к ним препаратов и кислорода была продемонстрирована Ван Таппенейром и Джесионеком в 1903 году, и авторами был предложен термин «фотодинамическая терапия» (ФДТ) [1]. На настоящий момент эффективность воздействия этого вида терапии на различные биологические структуры экспериментально подтверждена, а в клинической медицине задокументировано и систематизировано ее применение при онкологических и неонкологических заболеваниях. Так, в дерматологии ФДТ успешно используется от онкологических патологий, таких как базальноклеточный, плоскоклеточный рак, актинические и неонкологические кератозы, бактериальные, грибковые, вирусные, иммунологические или воспалительные инфекции, для лечения хронических ран и, наконец, в косметологии для фотоомоложения [2]. На рисунке представлена схема фотодинамической реакции и биологические эффекты ФДТ.
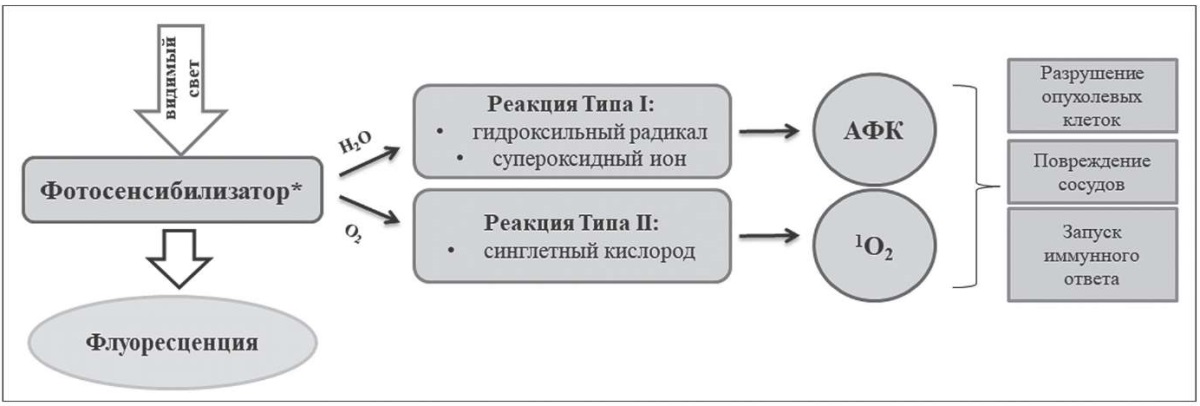
Рис. Схема фотодинамической реакции (подготовлена авторами).
Примечание: * – активированный светом фотосенсибилизатор.
Механизм эффективности этого типа терапии основан на цитотоксическом действии реактивных форм кислорода, генерируемых в клетках, при переносе энергии и/или электронов от фотовозбужденного сенсибилизатора (ФС). Нестабильные молекулы, особенно синглетный кислород, супероксидные анионы и гидроксильные радикалы, повреждают ДНК, РНК и мембранные белки, вызывая гибель клеток. Степень эффективности ФДТ при онкологии определяется тремя важными механизмами: во-первых, прямой гибелью опухолевых клеток, во-вторых, повреждением сосудов опухоли и, в-третьих, иммунологическим ответом, связанным со стимуляцией лейкоцитов и высвобождением ими интерлейкинов, факторов роста, компонентов комплемента, белков острой фазы и других иммунорегуляторов [2]. Широкое применение метода обусловлено сочетанием двух нетоксичных компонентов (ФС и свет видимого диапазона) для производства цитотоксического синглетного кислорода [2][3]. Кроме того, из-за способности сохранять анатомическую и функциональную целостность многих органов, простоты применения, селективности действия и отсутствия лекарственной резистентности ФДТ является минимально инвазивной альтернативой хирургическому вмешательству или радиотерапии. Помимо стимулирующего воздействия на продукцию реактивных молекул кислорода ФДТ обладает антибактериальной активностью, оказывает влияние путем активации металлопротеиназ на ремоделирование внеклеточного матрикса, стимулируя процесс заживления тканей [1][3].
Большинство существующих ФС активируются длинами волн в диапазоне 630–690 нм, при которых глубина проникновения света в ткани составляет всего 2–4 мм [4]. Область применения ФДТ в онкологии касается злокачественных поражений мочевого пузыря, кожи, легких, пищевода, шейки матки и др. [4]. Для решения проблемы более глубокого проникновения энергии световых волн в ткани часто используются длинноволновые источники, но серьезным препятствием для этого является перекрытие спектров поглощения и возбуждения ФС с потерей интенсивности действия [1]. Препараты первого поколения эффективны при лечении многих типов рака, однако всех их характеризует высокий уровень (до 20–40%) индуцированной кожной фототоксичности у пациентов, получавших фотофрин. Согласно исследовательским данным, процент ответа новообразования на ФДТ с использованием фотофрина при диаметре опухоли более 10 мм уменьшается с 98 до 43% [5].
Значительные усилия направлены на поиск более селективных к опухолям фотосенсибилизирующих агентов, и большинство ФС второго поколения относятся к циклическим тетрапирролам, в том числе производные порфирина, хлорина, фталоцианина и бактериохлорина. Зачастую эти препараты являются полностью синтетическими и обладают хорошей способностью к активации в клетках продукции синглетного кислорода. Тем не менее они обладают некоторыми недостатками: во-первых, способны вызывать высокий уровень болевых ощущений у пациента во время терапии; во-вторых, при воздействии облучением низкой интенсивности могут активироваться, что приводит к повышенной чувствительности окружающих здоровых тканей [6]. Разработка более совершенных ФС основывается на следующих критериях: химическая чистота с четко обозначенными физико-химическими свойствами; отсутствие темновой токсичности; селективность к ткани-мишени; высокий квантовый выход синглетного кислорода; минимальная фоточувствительность окружающих здоровых тканей; коммерческая доступность. Несмотря на то что несколько ФС третьего поколения, одобренных регулирующими органами здравоохранения для клинического применения, успешно применяются для лечения, параметры ни одного из них не являются полностью удовлетворяющими свойствам идеального препарата для ФДТ [6].
Комбинированное действие радио- и фотодинамической терапии
Поскольку онкологические заболевания являются одной из ведущих причин смертности, прилагаются значительные усилия для разработки оптимальных комбинированных методов лечения. Несмотря на успешность применения ФДТ в онкологии, ее действие ограничено глубиной проникновения в ткани организма волн инфракрасного диапазона и неидеальностью свойств существующих ФС. Лечение опухолей, недостижимых для энергии светового потока, требует инвазивных эндоскопических или лапароскопических подходов, которые могут быть также ограничены пределами возможностей используемого источника облучения по причине лимитированной проницаемости в ткани. С другой стороны, радиотерапия (РТ) традиционно является одним из наиболее распространенных и эффективных методов лечения рака [7]. Наиболее восприимчивыми к ней являются недифференцированные опухолевые клетки, поскольку обладают низкой способностью восстанавливать сублетальные повреждения ДНК [7]. За последние несколько десятилетий произошли существенные технологические и методологические усовершенствования РТ, а появление нанотехнологий способствовало резкому увеличению количества исследований в этой области. Так, синтезирован наноальбумин, связанный с доксорубицином и паклитакселом, затем инкапсулированный в липосомы, что позволяет ему специфически связываться с рецепторами опухолевых клеток [8][9]. Эти свойства нанокомплекса позволяют значительно снижать дозы облучения опухоли, но РТ по-прежнему ограничена неприемлемой токсичностью для окружающих нормальных тканей.
Известно, что некоторые опухолевые клетки устойчивы к ФДТ, но более чувствительны к ионизирующему излучению и наоборот [10]. Причем механизмы цитотоксического повреждения клеток при лучевой и ФДТ различаются. В первом варианте основной мишенью для гибели опухолевой клетки является разрушение ядерной ДНК, во-втором – ее гибель обусловлена действием молекул реактивного кислорода [11]. Таким образом, механизм действия ФДТ и РТ различен, но активация ФС Х-лучами позволяет проводить неинвазивное лечение глубоко расположенных опухолей, а синергизм между ними повышает эффективность противоопухолевой терапии. С этих позиций особый интерес представляют разработки в области инновационной радиофотодинамической терапии [12]. Предполагается, что потенциальный ущерб, нанесенный при радиотерапии, возможно свести к минимуму путем снижения дозы ионизирующего излучения при сохранении желаемого подавления роста опухоли.
В качестве примера комбинированной радиофотодинамической терапии можно привести применение индоцианинового зеленого (ICG) для лечения рака молочной железы. Комбинация ФС в концентрации 50 μM, облучения рентгеновским излучением в дозе 4 Гр 60 Дж/см² приводила к гибели раковых клеток и снижала процент их жизнеспособности до 3,42% при уменьшении побочных эффектов с должным уровнем повышения эффективности лечения [13]. Аналогичные результаты были получены при использовании митоксантрона в качестве сенсибилизатора. Подтвержден высокий цитотоксический эффект и дозозависимый ответ на клетках рака молочной железы MCF-7 при комбинации облучения рентгеновским излучением в дозе 4 Гр 10 Дж/см² со снижением жизнеспособности опухолевых клеток до 2,4 ± 1,15% [13][14].
Неопластическое заболевание кожи, болезнь Боуэна, рассматривается как ранняя стадия или внутриэпидермальная форма плоскоклеточной карциномы. Традиционные методы лечения этой болезни ограничены, отмечается высокая частота рецидивов и незаживающие язвы, особенно на нижних конечностях. Показатель излечения от этой болезни при местном применении 5-аминолевулиновой кислоты (ALA) и последующей комбинации ФДТ и РТ составил 80–100%. В данном случае синергетический эффект действия двух типов облучения позволил снизить дозу без негативных кожных эффектов [15]. Использование акридинового оранжевого в качестве ФС с последующим облучением в дозе 5 Гр при саркоме опорно-двигательного аппарата показало их 100% выживаемость до 48 месяцев при частоте рецидивов до 10%. Ни у одного из 5 пациентов, получавших такое лечение, не развился местный рецидив опухоли и не было обнаружено серьезных осложнений, таких, например, как гиперчувствительность кожи к свету [16]. Тем не менее стоит отметить, что успешность проводимой терапии зависит от множества параметров, включая тип патологии, дозу и мощность излучения, а также последовательность и временные промежутки в лечении. Следовательно, это новое малоизученное направление лечения опухолей требует дальнейших исследований: от свойств новосинтезируемых препаратов до клинических испытаний при условии междисциплинарной интеграции ученых.
Инновационные разработки в области радиофотодинамической терапии
Многофункциональные наночастицы определяются их размером от 1 до 1000 нм. ФС может быть инкапсулирован в сферу наночастиц или иммобилизован на их поверхности посредством ковалентных или нековалентных взаимодействий. Преимуществом такого подхода к синтезу субстанций является возможность создания специфической целевой доставки активного компонента в опухоль [17]. В 2006 году группой ученых во главе с Чен и Чжан была предложена концепция применения люминесцентных наночастиц для доставки порфирина [18]. Под воздействием рентгеновского излучения эти наночастицы испускают свечение, тем самым активируя ФС с последующей эффективной генерацией синглетного кислорода в опухолевых клетках. Использование излучения с высокой энергией (например, рентгеновского) позволяет применять ФС, предназначенные для поверхностно расположенных опухолей, для воздействия на более глубоком уровне. Медно-цистеаминовый комплекс (Cu-Cy) применяется в качестве нового структурированного ФС, активируемого светом видимого диапазона и рентгеновскими лучами в дозах от 1 до 8 Гр. При использовании этой наночастицы Cu-Cy и рентгеновского облучения отмечалось значительное разрушение клеток опухоли молочной железы MCF-7. Полученный комплекс продемонстрировал уникальные свойства: низкая цитотоксичность, простота синтеза и высокая эффективность клеточного поглощения [19].
Несмотря на перспективные результаты исследований эффективности РФДТ, существуют некоторые проблемы при синтезе таких соединений. Например, в качестве ФС зачастую используют порфирины или их производные, обладающие максимальным поглощением при длине волны возбуждения λ = 400 нм. Наночастицы, содержащие это соединение ФС и легированные лантанидами, часто демонстрируют сильную эмиссию между 450 и 600 нм, что не позволяет эффективно воздействовать на молекулу ФС. Процесс синтеза подобного уровня нанокомпозитов сложен и трудоемок, а эффективность люминесценции сцинтилляционных частиц ослабляется в процессе конъюгации [15]. В рамках решения этой проблемы синтезирована новая гибридная биосовместимая неорганическая наносистема на основе кремния SiC/SiOx ядро/оболочка, конъюгированная с ФС, производным тетракарбоксифенилпорфирина. Комплекс при облучении рентгеновским излучением мощностью 6 МэВ эффективно оказывает влияние на генерацию синглетного кислорода 1О2 клетками с индукцией окислительного стресса при крайне малых дозах (0,4 Гр) [20]. Другая интегрированная наносистема на основе металлосодержащего ядра стронций/алюминий/европий SrAl2O4:Eu2+ и мезопористого кремнеземного покрытия с включением ФС мероцианина 540 использовалась для активации последнего с применением рентгеновского облучения. Лечение опухоли с использованием такой наносистемы и низкоэнергического облучения (при дозе 0,5 Гр) привело к эффективному сокращению ее размера при сохранении нормальных тканей [21].
При совместном сотрудничестве ученых Центральной научно-исследовательской лаборатории Тихоокеанского государственного медицинского университета и Института химии ДВО РАН с 2023 года реализуется научно-исследовательский проект по разработке ФС нового поколения. Синтезированы комплексы на основе природного порфирина Хлорина е6 с включением европия или самария. Состав комплексных соединений подтвержден с привлечением методов сканирующей электронной микроскопии, инфракрасной и люминесцентной спектроскопии. Показано, что люминесценция комплексных соединений Хлорина е6 с Eu3+ или Sm3+ проявляется в широкой области спектра от 400 до 800 нм. В отсутствие облучения продемонстрирована дозозависимая низкая цитотоксичность в отношении клеток асцитной аденокарциномы Эрлиха. Показатели жизнеспособных клеток в диапазоне вносимых концентраций от 12,5 до 100 мкг/мл составили от 75,4 ± 3,8 до 96,5 ± 4,8%. Запланированы дальнейшие исследования противоопухолевой эффективности синтезированных систем с использованием различных вариантов облучения (красного света и тормозного ионизирующего излучения) с целью разработки технологии РФДТ при онкологических заболеваниях.
Заключение
Представленный инновационный метод комбинированной фотодинамической терапии в настоящее время находится преимущественно в стадии разработки: от синтеза ФС нового поколения до исследования их эффективности на моделях in vitro. Одним из сложнейших вопросов остается подбор доз облучения для активации молекул ФС без их разрушения, а также определение временного интервала между введением таргетного препарата и воздействием излучения. Недостаточно информации о фотоиндуцированной токсичности разрабатываемых препаратов и испытаниях их действия на моделях in vivo. Все вышесказанное обуславливает перспективу дальнейших исследований в области радиофотодинамической терапии.
Конфликт интересов: авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Источник финансирования: исследования выполняются в рамках Программы стратегического академического лидерства «Приоритет 2030». Регистрационный номер ЕГИСУ НИОКТР 123112300008-1.
Участие авторов:
Концепция и дизайн исследования – ПНГ, АВИ, ММА, СТИ
Сбор и обработка материала – ШОВ
Написание текста – ШОВ, ПНГ
Редактирование – ШВБ, ПНГ, ТЛВ, ЛСВ
Список литературы
1. Moghissi K, Allison RR. A narrative history of photodynamic therapy. Nanomaterials for Photodynamic Th erapy. Woodhead Publishing. 2023;1–39. doi:10.1016/B978-0-323-85595-2.00010-4
2. Бейманова М.А., Петунина В.В., Шилов Б.В., Белхароева Р.Х. Сравнительный анализ эффективности фотодинамической терапии при инволюционных изменениях кожи в монотерапии и в комбинации с фотосенсибилизирующими средствами на основе хлорина E6. Клиническая дерматология и венерология. 2021;20(6):126–32. doi: 10.17116/klinderma202120061126
3. Мансурова К.А., Потешкина Д.А., Антонец С.В., Солодко Т.И. Терапия с использованием ускорителей электронов. Актуальные научные исследования в современном мире. 2021;3(1):89–93.
4. Сажнев Д.И., Андреев А.А., Глухов А.А. Фотодинамическая терапия. Вестник экспериментальной и клинической хирургии. 2019;12(2):141–6. doi: 10.18499/2070-478X2019-12-2-141-146
5. Li X, Lovell JF, Yoon J, Chen X. Clinical development and potential of photothermal and photodynamic therapies for cancer. Nat Rev Clin Oncol. 2020;17(11):657–74. doi: 10.1038/s41571-020-0410-2
6. Correia JH, Rodrigues JA, Pimenta S, Dong T, Yang Z. Photodynamic therapy review: principles, photosensitizers, applications, and future directions. Pharmaceutics. 2021;13(9):1332. doi: 10.3390/pharmaceutics13091332
7. Привалов М.П. Радиопротекторы и радиосенсибилизаторы – химические агенты, модулирующие чувствительность клеток к ионизирующему облучению. Актуальные проблемы биологии и медицинской паразитологии. 2021;48–52.
8. Lowery A, Onishko H, Hallahan DE, Han Z. Tumor-targeted delivery of liposome-encapsulated doxorubicin by use of a peptide that selectively binds to irradiated tumors. J Control Release. 2011;150(1):117–24. doi: 10.1016/j.jconrel.2010.11.006
9. Zhao X, Liu J, Fan J, Chao H, Peng X. Recent progress in photosensitizers for overcoming the challenges of photodynamic therapy: from molecular design to application. Chem Soc Rev. 2021;50(6):4185–219. doi: 10.1039/D0CS00173B
10. Кузнецова В.В. Опухолевая резистентность: роль внеклеточного компартмента. Авиценна. 2020;56:15–9.
11. Lv L, Fan B, Ji X, Liu Y, Chen T, Li Y, Chen G. From the clinical perspective of photodynamic therapy and photothermal therapy: structure-activity-practice. Coordination Chemistry Reviews. 2024;507:215733. doi: 10.1016/j.ccr.2024.215733
12. Xu J, Gao J, Wei Q. Combination of photodynamic therapy with radiotherapy for cancer treatment. J Nanomaterials. 2016:12016. doi: 10.1155/2016/8507924
13. Porcu EP, Salis A, Gavini E, Rassu G, Maestri M, Giunchedi P. Indocyanine green delivery systems for tumour detection and treatments. Biotechnol Adv. 2016;34(5):768–89. doi: 10.1016/j.biotechadv.2016.04.001
14. Darwish W, Lafta RA, Shafaa MW, El-Nagdy MS. Mitoxantrone in synergism with gold hexagonal nanoparticles and gamma radiation for effective treatment of MCF7 cells. Egypt J Chem. 2022;65(3):647–55. doi: 10.21608/ejchem.2021.86310.4185
15. Antonetti P, Pellegrini C, Caponio C, Bruni M, Dragone L, Mastrangelo M, Fargnoli MC. Photodynamic therapy for the treatment of Bowen’s disease: areview on efficacy, noninvasive treatment monitoring, tolerability, and cosmetic outcome. Biomedicines. 2024;12(4):795. doi: 10.3390/biomedicines12040795
16. Kusuzaki K, Murata H, Matsubara T, Miyazaki S, Okamura A, Seto M, Uchida A. Clinical trial of photodynamic therapy using acridine orange with/without low dose radiation as new limb salvage modality in musculoskeletal sarcomas. Anticancer Res. 2005;25(2):1225–35.
17. De Crozals G, Bonnet R, Farre C, Chaix C. Nanoparticles with multiple properties for biomedical applications: A strategic guide. Nano Today. 2016;11(4):435–63. doi: 10.1016/j.nantod.2016.07.002
18. Zhang P, Hu C, Ran W, Meng J, Yin Q, Li Y. Recent progress in light-triggered nanotheranostics for cancer treatment. Th eranostics. 2016;6(7):948. doi: 10.7150/thno.15217
19. Shrestha S, Wu J, Sah B, Vanasse A, Cooper LN, Ma L, Antosh MP. X-ray induced photodynamic therapy with copper-cysteamine nanoparticles in mice tumors. Proc Natl Acad Sci USA. 2019;116(34):16823–8. doi: 10.1073/pnas.1900502116
20. Huang Y, Liu J, Liu X, Sun J, Liu X. Synthesis of photoluminescent SiC-SiOx nanowires using coal tar pitch as carbon source. Ceramics Int. 2020;46(17):27232–7. doi: 10.1016/j.ceramint.2020.07.207
21. Delgado T, Afshani J, Hagemann H. Spectroscopic study of a single crystal of SrAl2O4:Eu2+:Dy3+. J Phys Chem 2020; 123(14):8607–13. doi: 10.1021/acs.jpcc.8b12568
Об авторах
В. Б. ШуматовРоссия
Владивосток
О. В. Шевченко
Россия
Шевченко Ольга Вячеславовна – научный сотрудник Центральной научно-исследовательской лаборатории
690002, г. Владивосток, пр-т Острякова, 2
+7 (924) 428-17-91
Н. Г. Плехова
Россия
Владивосток
В. И. Апанасевич
Россия
Владивосток
М. А. Медков
Россия
Н. И. Стеблевская
Россия
Л. В. Транковская
Россия
Владивосток
С. В. Лебедев
Россия
Владивосток
Рецензия
Для цитирования:
Шуматов В.Б., Шевченко О.В., Плехова Н.Г., Апанасевич В.И., Медков М.А., Стеблевская Н.И., Транковская Л.В., Лебедев С.В. Инновационные разработки в рамках междисциплинарных исследований: препараты для радио- и фотодинамической терапии. Тихоокеанский медицинский журнал. 2024;(2):5-9. https://doi.org/10.34215/1609-1175-2024-2-5-9
For citation:
Shumatov V.B., Shevchenko O.V., Plekhova N.G., Apanasevich V.I., Medkov M.A., Steblevskaya N.I., Trankovskaya L.V., Lebedev S.V. Innovative developments in the framework of interdisciplinary research: Drugs for radio- and photodynamic therapy. Pacific Medical Journal. 2024;(2):5-9. (In Russ.) https://doi.org/10.34215/1609-1175-2024-2-5-9





































