Перейти к:
Сравнительная оценка качества визуализации надпочечниковых артерий у экспериментальных животных
https://doi.org/10.34215/1609-1175-2024-2-51-54
Аннотация
По данным прижизненной ангиографии дана оценка качества визуализации надпочечниковых артерий у экспериментальных животных для дальнейшего изучения различных технологий эмболизации. Исследование выполнено на материале половозрелых кроликов (n = 5) и свиней (n = 5). Всем животным проводилась мультиспиральная компьютерная томография (МСКТ) в режиме ангиографии на аппарате Briliance 64 (Phillips), а затем инвазивная ангиография аорты и висцеральных артерий с использованием передвижного рентген-аппарата типа C-дуга (Siemens). Межгрупповой анализ результатов МСКТ-ангиографии и инвазивной ангиографии аорты и висцеральных артерий демонстрирует непригодность кроликов для проведения селективной катетеризации надпочечниковых артерий из-за их малого диаметра. При этом выполнение инвазивной артериографии у свиней позволяет визуализировать с обеих сторон основные ветви артерий, питающие надпочечники и подходящие для изучения методики эмболизации.
Ключевые слова
Для цитирования:
Аннаев М.С., Стегний К.В., Гельцер Б.И., Пак О.И., Гончарук Р.А., Селютин С.М., Маслянцев Е.В., Фисенко В.Г., Двойникова Е.Р., Чернышенко Т.С., Мамедов В.Р., Бекерова Д.Ф., Стародубцева Т.Д. Сравнительная оценка качества визуализации надпочечниковых артерий у экспериментальных животных. Тихоокеанский медицинский журнал. 2024;(2):51-54. https://doi.org/10.34215/1609-1175-2024-2-51-54
For citation:
Annaev M.S., Stegniy K.V., Geltser B.I., Pak O.I., Goncharuk R.A., Seliutin S.M., Maslyantsev E.V., Fisenko V.G., Dvoinikova E.R., Chernyshenko T.S., Mamedov V.R., Bekerova D.F., Starodubtseva T.D. Comparative evaluation of imaging quality of the adrenal artery in experimental animals. Pacific Medical Journal. 2024;(2):51-54. (In Russ.) https://doi.org/10.34215/1609-1175-2024-2-51-54
При лечении новообразований напдпочечников часто применяется лапароскопическая адреналэктомия [1–4]. Такие радикальные операции ассоциируются с высоким риском развития надпочечниковой недостаточности, что актуализирует потребность в органосохраняющих хирургических вмешательствах [5–8]. В связи с активным внедрением в клиническую практику методов рентгенэндоваскулярной хирургии постоянно расширяется спектр ее применения, в том числе за счет совершенствования технологий эмболизации артерий, питающих пораженный орган. Очевидны преимущества метода по отношению к частичной адреналэктомии для лечения гормонпродуцирующих аденом надпочечников и идиопатической формы первичного гиперальдостеронизма [9][10]. Изучение различных аспектов ангиоархитектоники надпочечников позволяет оптимизировать методы эффективного лечения эмболии надпочечниковых артерий.
В настоящей работе на основе прижизненной ангиографии дана оценка качества визуализации надпочечниковых артерий у экспериментальных животных для дальнейшего изучения технологий эмболизации.
Исследование одобрено решением локального этического комитета Школы медицины и наук о жизни Дальневосточного федерального университета (протокол № 8 от 08.06.2023 г.). В работе использованы 5 кроликов-самцов рода Oryctolagus cuniculus domestic в возрасте 17 ± 1 неделя, весом 2,9 ± 0,3 кг и 5 свиней-самцов вьетнамской вислобрюхой породы в возрасте 16 ± 1 неделя, весом 19 ± 1,5 кг. Животные содержались в условиях, отвечающих гигиеническим и санитарно-эпидемиологическим нормам согласно ГОСТ 33215-2014 «Руководство по содержанию и уходу за лабораторными животными. Правила оборудования помещений и организации процедур», ГОСТ 33216-2014 «Руководство по содержанию и уходу за лабораторными животными. Правила содержания и ухода за лабораторными грызунами и кроликами» и ГОСТ 34088-2017 «Руководство по содержанию и уходу за лабораторными животными. Правила содержания и ухода за сельскохозяйственными животными». Срок адаптации животных составлял для кроликов – 7, для свиней – 5 дней.
Дизайн исследования включал 2 этапа. На первом всем животным была проведена мультиспиральная компьютерная томография (МСКТ) в режиме ангиографии. Процедура проводилась под общим наркозом, который выполняли ксилазином гидрохлоридом в дозе 4,0 мг/кг внутримышечно для премедикации с дальнейшим введением 5 мг/кг золетила-50. МСКТ-ангиография проводилась на установке Philips «Briliance 64» в режиме спирального сканирования с мультипланарной и ЗD-реконструкцией в положении животного на спине с зафиксированными к столу конечностями. Выполнено болюсное введение контрастного вещества Омнипак 300 в концентрации 1,0 мл/кг внутривенно через установленный в вену ушной раковины периферический катетер диаметром 22G. После МСКТ животные наблюдались в отдельном помещении до полного пробуждения.
На втором этапе животным проведена инвазивная ангиография аорты и висцеральных артерий на передвижной рентген-установке Siemens Healthineers Cios Spin (С-дуга). За 30 минут до исследования под вводным наркозом ксилазином гидрохлоридом и золетилом-50 всем животным проводилась санитарно-гигиеническая обработка, которая включала очистку от загрязнений, выбривание шерсти и обработку кожи пункционной области моющими средствами. Через установленный в вену ушной раковины периферический катетер 22G проводилась болюсная индукция пропофолом в дозе 1 мг/кг с титрованием до необходимой глубины наркоза и дальнейшим его введением через инфузомат со скоростью 10 мг/кг/ч. О качестве наркоза судили по отсутствию болевой чувствительности, определяемой по реакции на прокол ушной раковины, и угнетения кашлевого и дыхательного центров. Пункция общей бедренной артерии проводилась под местной анестезией 1% раствором лидокаина 2,0 мл и ультразвуковым контролем на аппарате Mindray M9T по методике Сельдингера с установкой интродьюсера 5F. Далее с помощью катетера JR-5F и контрастного вещества Омнипак-300 проводилась аортография и селективная ангиография висцеральных артерий. Общее количество введенного контрастного вещества составляло 15 ± 5 мл для кроликов и 40 ± 5 мл – для свиней. По окончании исследования интродьюсер извлекался, и выполнялся компрессионный гемостаз. Для профилактики контраст-индуцированной нефропатии проводилась внутривенная инфузионная терапия 0,9% раствором NaCl в дозе 10 мл/кг. После исследования животные наблюдались в изолированном помещении до полного пробуждения под контролем состояния жизненно важных функций. Побочные эффекты и осложнения не фиксировались.
По данным МСКТ выполнен сравнительный анализ топографии и размеров висцеральных артерий. Статистическая обработка результатов проводилась с использованием компьютерной программы Statistica 25.0. Учитывались показатели средней выборки и ошибки средней выборки (M ± m). Достоверность различий показателей определялась с помощью критерия Стьюдента (р < 0,05).Сопоставление результатов МСКТ-ангиографии у кроликов и свиней демонстрировало различие ангиоархитектоники надпочечников. Так, по данным анализа снимков абдоминальной аорты кроликов было установлено, что она имеет прямолинейный ход, а ее диаметр составляет: супраренально – 4,8 ± 0,2 мм и инфраренально – 2,5 ± 0,2 мм. Диаметры чревного ствола, верхней брыжеечной, почечных и нижней брыжеечной артерий фиксировались на уровне 1,7 ± 0,096, 1,6 ± 0,076, 1,5 ± 0,082 и 1,2 ± 0,053 мм соответственно. При этом васкуляризация надпочечников отчетливо не определялась (рис. 1 А, Б).
По результатам инвазивной ангиографии брюшного отдела аорты и висцеральных сосудов у кроликов визуализировались чревный ствол, почечные и брыжеечные артерии, диаметр которых соответствовал данным МСКТ. Достоверной дифференцировки кровоснабжения надпочечников добиться не удалось ввиду малого диаметра питающих их артерий. В связи с тем что в настоящее время в арсенале рентген-эндоваскулярного инструментария отсутствуют катетеры соответствующего диаметра, дальнейшие исследования на данной группе животных не проводились (рис. 1 В, Г).
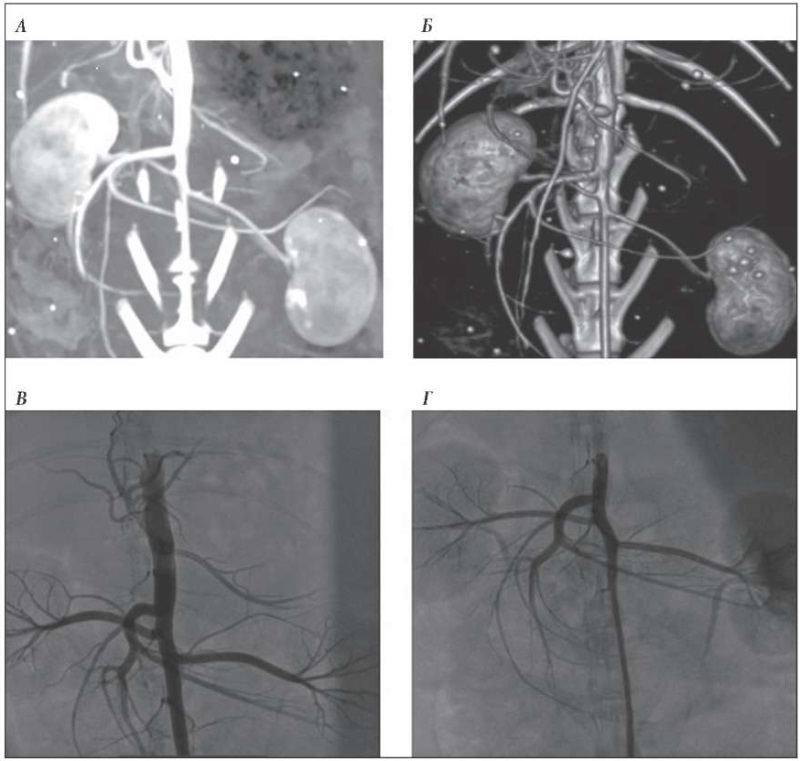
Рис. 1. МСКТ и инвазивная ангиография аорты и висцеральных сосудов у кролика:
А – мультипланарная реконструкция; Б – 3D-реконструкция;
В, Г – ангиография брюшного отдела аорты и висцеральных сосудов.
По данным МСКТ-ангиографии абдоминальной аорты у свиней определялся ее прямолинейный ход с диаметром супраренально – 10 ± 0,2 мм, инфраренально – 6,5 ± 0,2 мм. Диаметр чревного ствола составлял 5,2 ± 0,043 мм, верхней брыжеечной артерии – 4,3 ± 0,034 мм, почечных артерий – 2,5 ± 0,018 мм, нижней брыжеечной – 2,1 ± 0,074 мм (таблица). Васкуляризация надпочечников достоверно не дифференцировалась (рис. 2 А, Б).
Таблица
Сравнительный анализ размеров висцеральных артерий по данным МСКТ (M + m)
Наименование артерии | Диаметр артерий, мм | P | |
Кролики | Свиньи | ||
Чревный ствол | 1,7 ± 0,096 | 5,2 ± 0,043 | < 0,0001 |
Верхняя брыжеечная артерия | 1,6 ± 0,076 | 4,3 ± 0,034 | < 0,0001 |
Нижняя брыжеечная артерия | 1,2 ± 0,053 | 2,1 ± 0,074 | 0,00026 |
Почечные артерии | 1,5 ± 0,082 | 2,5 ± 0,018 | 0,00034 |
По результатам инвазивной ангиографии визуализировались чревный ствол, мезентериальные и почечные артерии с отходящими от них ветвями, кровоснабжающими надпочечники. Диаметры сосудов соответствовали размерам, установленным на МСКТ. Надпочечниковые артерии отходили непосредственно от почечных, отступая на 3–5 мм от их устья. У одной из пяти свиней данная артерия была обнаружена только с правой стороны, что свидетельствует о различных вариантах кровоснабжения надпочечников. В дальнейшем поочередно, с помощью коронарного проводника Fielder-Asahi была успешно выполнена селективная катетеризация левой и правой надпочечниковых артерий микрокатетером Corsair и проведена ангиография. Тугое контрастирование паренхимы надпочечников являлось подтверждением того, что данная артерия является одной из основных ветвей кровоснабжения надпочечников (рис. 2 В, Г, Д, Е).
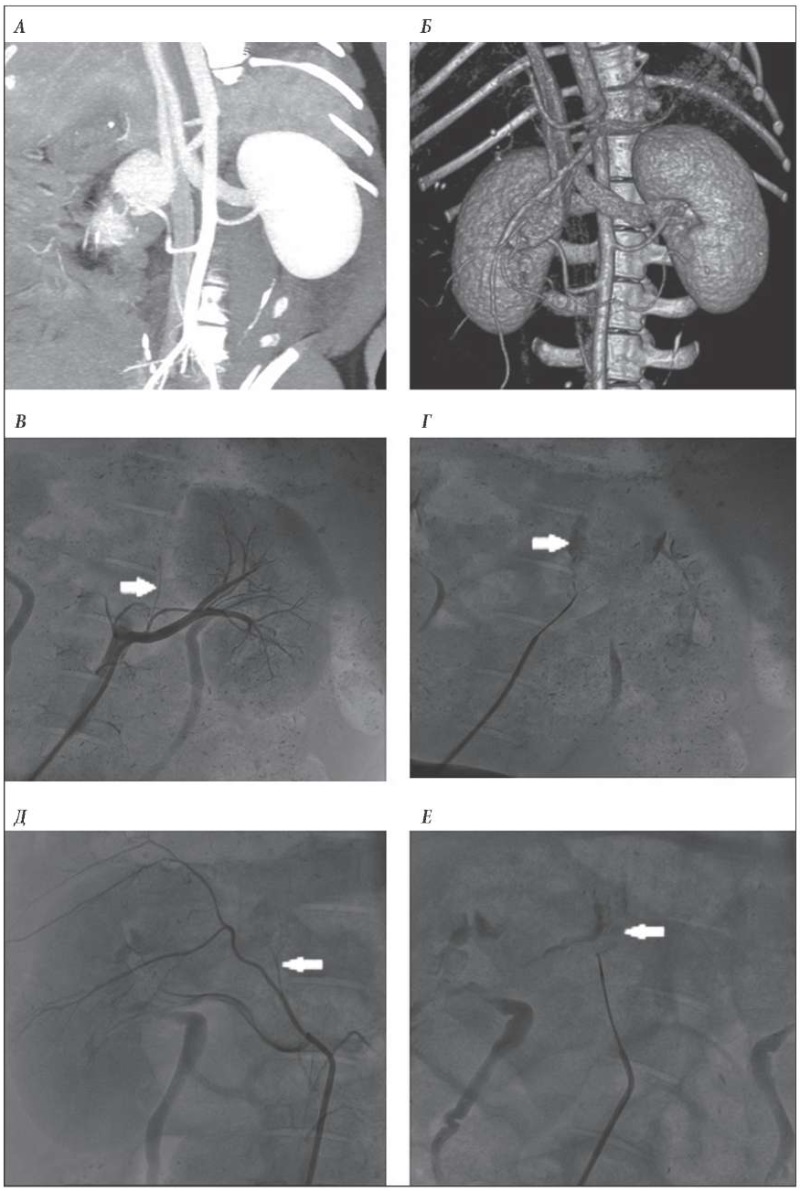
Рис. 2. МСКТ и инвазивная ангиография аорты и висцеральных сосудов у свиньи:
А – мультипланарная реконструкция МКСТ;
Б – 3D-реконструкция МСКТ;
В – селективная ангиография левой почечной артерии.
Стрелкой указана надпочечниковая артерия;
Г – селективная ангиография левой надпочечниковой артерии через микрокатетер Corsair;
стрелкой указана законтрастированная надпочечниковая паренхима.
Д – селективная ангиография правой почечной артерии.
Стрелкой указана надпочечная артерия;
Е – селективная ангиография правой надпочечниковой артерии через микрокатетер Corsair.
Стрелкой указана законтрастированная надпочечниковая паренхима.
Эмболизация артерий, питающих надпочечники, в последние годы рассматривается как один из альтернативных методов лечения заболеваний, связанных с гиперпродукцией гормонов [7–10]. Детальное исследование морфофункциональных изменений паренхимы, индуцированных эмболизацией, возможно в условиях эксперимента. Сравнительный анализ результатов комплексного ангиографического исследования демонстрирует особенности кровоснабжения надпочечников у кроликов и свиней. Данные МСКТ и инвазивной ангиографии кроликов указывали на непригодность этого вида животных для проведения дальнейших исследований ввиду невозможности селективной катетеризации артерий, питающих надпочечники из-за их малого диаметра. При этом выполнение селективной ангиографии вьетнамским вислобрюхим свиньям позволило визуализировать с обеих сторон артерии, которые являлись основными ветвями, питающими данный орган. Надпочечниковые артерии у свиней могут представлять различные анатомо-топографические варианты [11]. В нашем исследовании у одной из свиней не удалось обнаружить левую надпочечниковую артерию в типичном месте. В то же время у больших белых свиней были описаны 3 артерии, питающие надпочечники [12]. Полученные данные указывают, что вьетнамские вислобрюхие свиньи являются оптимальным объектом для экспериментального исследования ввиду их малого размера и анатомического строения артериального русла.
Результаты ангиографических исследований показали, что у свиней вьетнамской вислобрюхой породы ангиоархитектоника надпочечников позволяет выполнить процедуру эмболизации питающих их артерий, что создает условия для дальнейшего изучения морфофункциональных изменений ткани надпочечников при использовании эмболизирующих материалов различных типов. У кроликов выполнение селективной катетеризации надпочечниковых артерий невозможно из-за их малого диаметра.
Конфликт интересов: авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Источники финансирования: работа выполнена в рамках проекта FZNS-2023-0010 Госзадания ДВФУ.
Участие авторов:
Концепция и дизайн исследования – МСА, КВС, ОИП, ЕРД, ТДС
Сбор и анализ материала – МСА, БИГ, СМС, ЕВМ, ТСЧ, ВРМ, ДФБ
Написание текста – МСА, РАГ, ВГФ, БИГ
Редактирование – КВС, БИГ, РАГ, ОИП
Список литературы
1. Gagner M, Lacroix A, Bolté E. Laparoscopic adrenalectomy in Cushing’s syndrome and pheochromocytoma. N Engl J Med. 1992 Oct 1;327(14):1033. doi: 10.1056/NEJM199210013271417
2. Di Dalmazi G, Berr CM, Fassnacht M, Beuschlein F, Reincke M. Adrenal function after adrenalectomy for subclinical hypercortisolism and Cushing’s syndrome: a systematic review of the literature. J Clin Endocrinol Metab. 2014 Aug;99(8):2637–45. doi: 10.1210/jc.2014-1401
3. Kulshreshtha B, Arora A, Aggarwal A, Bhardwaj M. Prolonged adrenal insufficiency after unilateral adrenalectomy for Cushing’s Syndrome. Indian J Endocrinol Metab. 2015 May- Jun;19(3):430–2. doi: 10.4103/2230-8210.152794
4. Fischer E, Hanslik G, Pallauf A, Degenhart C, Linsenmaier U, Beuschlein F, Bidlingmaier M, Mussack T, Ladurner R, Hallfeldt K, Quinkler M, Reincke M. Prolonged zona glomerulosa insufficiency causing hyperkalemia in primary aldosteronism after adrenalectomy. J Clin Endocrinol Metab. 2012 Nov;97(11):3965–73. doi: 10.1210/jc.2012-2234
5. Park KS, Kim JH, Ku EJ, Hong AR, Moon MK, Choi SH, Shin CS, Kim SW, Kim SY. Clinical risk factors of postoperative hyperkalemia after adrenalectomy in patients with aldosterone-producing adenoma. Eur J Endocrinol. 2015 Jun;172(6):725–31. doi: 10.1530/EJE-15-0074
6. Heinrich DA, Adolf C, Holler F, Lechner B, Schneider H, Riester A, Nirschl N, Sturm L, Wang X, Ladurner R, Seidensticker M, Bidlingmaier M, Beuschlein F, Reincke M. Adrenal Insufficiency After Unilateral Adrenalectomy in Primary Aldosteronism: Long-Term Outcome and Clinical Impact. J Clin Endocrinol Metab. 2019 Nov 1;104(11):5658–64. doi: 10.1210/jc.2019-00996
7. Zhou Y, Wang D, Liu Q, Hou J, Wang P. Case report: Percutaneous adrenal arterial embolization cures resistant hypertension. Front Cardiovasc Med. 2022 Oct 11;9:1013426. doi: 10.3389/fcvm.2022.1013426
8. Van der Walt IS, Brown M, Lodh S. Adrenal gland-sparing transcatheter embolisation of an aldosteronoma for the treatment of refractory hypertension. Radiol Case Rep. 2022 Feb 4;17(4):1088–94. doi: 10.1016/j.radcr.2022.01.043
9. Dong H, Zou Y, He J, Deng Y, Chen Y, Song L, Xu B, Gao R, Jiang X. Superselective adrenal arterial embolization for idiopathic hyperaldosteronism: 12-month results from a proof-of-principle trial. Catheter Cardiovasc Interv. 2021 May 1;97(2):976–81. doi: 10.1002/ccd.29554
10. Qiu J, Li N, Xiong HL, Yang J, Li YD, Hu CK, Lai ZQ, Liang NP, Zhang HJ, Jiang XJ, Dong YF. Superselective adrenal arterial embolization for primary aldosteronism without lateralized aldosterone secretion: an efficacy and safety, proof-of-principle study. Hypertens Res. 2023 Mar 3. doi: 10.1038/s41440-023-01236-8
11. Edwards J, Abdou H, Patel N, Madurska MJ, Poe K, Bonin JE, Richmond MJ, Rasmussen TE, Morrison JJ. The functional vascular anatomy of the swine for research. Vascular. 2022 Apr;30(2):392–402. doi: 10.1177/1708538121996500
12. Suzuki K, Nagai H, Hoshino T, Tamate H. The Branching site of the posterior adrenal artery in pigs. Okajimas folia anatomica Japonica. 1985 May; 62 (1): 27–34. doi: 10.2535/ofaj1936.62.1_27
Об авторах
М. С. АннаевРоссия
Аннаев Мейлис Сердарович – аспирант Школы медицины и наук о жизни
690922, г. Владивосток, о. Русский, поселок Аякс, 10, ДВФУ, корпус 6.2
+7 (925) 014-81-51
К. В. Стегний
Россия
Владивосток
Б. И. Гельцер
Россия
Владивосток
О. И. Пак
Россия
Владивосток
Р. А. Гончарук
Россия
Владивосток
С. М. Селютин
Россия
Владивосток
Е. В. Маслянцев
Россия
Владивосток
В. Г. Фисенко
Россия
Владивосток
Е. Р. Двойникова
Россия
Владивосток
Т. С. Чернышенко
Россия
Владивосток
В. Р. Мамедов
Россия
Владивосток
Д. Ф. Бекерова
Россия
Владивосток
Т. Д. Стародубцева
Россия
Владивосток
Рецензия
Для цитирования:
Аннаев М.С., Стегний К.В., Гельцер Б.И., Пак О.И., Гончарук Р.А., Селютин С.М., Маслянцев Е.В., Фисенко В.Г., Двойникова Е.Р., Чернышенко Т.С., Мамедов В.Р., Бекерова Д.Ф., Стародубцева Т.Д. Сравнительная оценка качества визуализации надпочечниковых артерий у экспериментальных животных. Тихоокеанский медицинский журнал. 2024;(2):51-54. https://doi.org/10.34215/1609-1175-2024-2-51-54
For citation:
Annaev M.S., Stegniy K.V., Geltser B.I., Pak O.I., Goncharuk R.A., Seliutin S.M., Maslyantsev E.V., Fisenko V.G., Dvoinikova E.R., Chernyshenko T.S., Mamedov V.R., Bekerova D.F., Starodubtseva T.D. Comparative evaluation of imaging quality of the adrenal artery in experimental animals. Pacific Medical Journal. 2024;(2):51-54. (In Russ.) https://doi.org/10.34215/1609-1175-2024-2-51-54





































