Перейти к:
Факторы патогенности и антибиотикорезистентность штаммов Enterococcus faecalis, выделенных из секрета предстательной железы у мужчин с хроническим бактериальным простатитом
https://doi.org/10.34215/1609-1175-2024-2-60-64
Аннотация
Цель: характеристика патогенных фено- и генопрофилей, а также антибиотикорезистентности штаммов Enterococcus faecalis, выделенных из секрета предстательной железы у мужчин с хроническим бактериальным простатитом (ХБП).
Материалы и методы. Энтерококки выделены стандартным бактериологическим методом и идентифицированы методом масс-спектрометрии. Генетические детерминанты, кодирующие факторы патогенности и антибиотикорезистентности, определены методом полимеразной цепной реакции. Фотометрическим методом выявлена способность энтерококков инактивировать лизоцим, образовывать биопленки, проявлять гемолиз и адгезию, методом иммуноферментного анализа оценена sIgA-протеазная и антицитокиновая активности.
Результаты. Выделенные штаммы E. faecalis обладали выраженным патогенным потенциалом: характеризовались наличием факторов вирулентности (гемолитическая активность, адгезивная способность) и персистенции, способностью к инактивации провоспалительных цитокинов и sIgA, вариабельной антибиотикорезистентностью с устойчивостью к амикацину и канамицину. В генотипе культур E. faecalis определены детерминанты, ответственные за синтез протеолитических ферментов (gelE, sprE) и цитолизина (комплекс генов cyl-оперона), а также отвечающие за уклонение от эффекторов иммунитета макроорганизма (esp) и синтез белков-адгезинов (asa). У всех изолятов установлено наличие генетических детерминант антибиотикорезистентности aph(3')-IIIa, tetM, vanA.
Заключение. Полученные результаты о патогенных биопрофилях клинических штаммов энтерококков могут быть использованы для усовершенствования подходов к диагностике ХБП. Данные об антибиотикорезистентности (на уровне фено- и генотипа) необходимо учитывать при эмпирическом и персонифицированном выборе препаратов для комплексной терапии пациентов с ХБП.
Ключевые слова
Для цитирования:
Карташова О.Л., Пашинина О.А., Пашкова Т.М., Гриценко В.А., Попова Л.П. Факторы патогенности и антибиотикорезистентность штаммов Enterococcus faecalis, выделенных из секрета предстательной железы у мужчин с хроническим бактериальным простатитом. Тихоокеанский медицинский журнал. 2024;(2):60-64. https://doi.org/10.34215/1609-1175-2024-2-60-64
For citation:
Kartashova O.L., Pashinina O.A., Pashkova T.M., Gritsenko V.A., Popova L.P. Pathogenicity factors and antibiotic resistance strains of Enterococcus faecalis isolated from prostate secretions in males with chronic bacterial prostatitis. Pacific Medical Journal. 2024;(2):60-64. (In Russ.) https://doi.org/10.34215/1609-1175-2024-2-60-64
Хронический бактериальный простатит (ХБП) характеризуется затяжным течением, частыми рецидивами и значительно ухудшает качество жизни мужчин репродуктивного возраста. Одной из причин воспалительного процесса предстательной железы является ее инфицирование условно-патогенными бактериями [1].
Спектр микроорганизмов, вызывающих развитие ХБП, окончательно не определен [2]. B. Lobel и A. Rodriguez [3] в проведенном комплексном исследовании выделили 5 групп микроорганизмов, которые могут быть причастны к развитию ХБП, включив во вторую группу (вероятные патогены) грамположительные кокки – Enterococcus spp., Staphylococcus spp. Из секрета предстательной железы пациентов с ХБП Enterococcus faecalis и E. faecium выделяются в 23–42% случаев как в монокультуре, так и в ассоциациях со стафилококками [4]. При этом среди условно-патогенных бактерий превалируют E. faecalis [2].
Следует отметить, что патогенный потенциал энтерококков, изолируемых из урогенитального тракта мужчин при ХБП, изучен недостаточно [2][3]. Безусловный клинический интерес представляют данные фенотипического и молекулярно-генетического типирования антибиотикорезистентности урогенитальных изолятов E. faecalis, которые необходимы для внутрибольничного мониторинга формирования устойчивости к антибактериальным препаратам и могут быть использованы при выборе средств эмпирической терапии ХБП.
Указанные обстоятельства определили цель настоящего исследования – охарактеризовать патогенные фено- и генопрофили, а также антибиотикорезистентность штаммов Enterococcus faecalis, выделенных из секрета предстательной железы у мужчин с хроническим бактериальным простатитом.
Материалы и методы
В эксперименте использованы 22 штамма Enterococcus faecalis, выделенных из секрета предстательной железы у 43 мужчин репродуктивного возраста (20–45 лет) с ХБП. Микроорганизмы были выделены с помощью стандартных бактериологических методов и идентифицированы с помощью масс-спектрометра MALDI-TOF серии Microflex (Bruker Daltonics, Германия).
Фотометрическим методом определены антилизоцимная активность микроорганизмов (АЛА) [5], способность образовывать биопленки (БПО) [6], адгезия (ПА) [7], гемолиз (ГА – гемолитическая активность) [8], иммуноферментным методом – sIgA – протеазная активность [9] и способность энтерококков вызывать изменение концентраций IL17A, TNFα, IL8 [10].
Резистентность микроорганизмов к антибактериальным препаратам определяли диско-диффузионным методом в соответствии с методическими указаниями 4.2.1890-04 «Определение чувствительности микроорганизмов к антибактериальным препаратам» [11]. В работе использовали официнальные диски с амикацином, канамицином, неомицином, гентамицином, ванкомицином и тетрациклином (ЗАО «НИЦФ», Санкт-Петербург).
ДНК выделяли из суточной агаровой культуры энтерококков с помощью набора «ДНК-сорб-В» («ИнтерЛабСервис», Россия). Амплификацию ДНК осуществляли на амплификаторе «Терцик МС-2» («ДНК-технология», Россия).
Присутствие генов патогенности и резистентности определяли с помощью специфической и мультиплексной полимеразной цепной реакции (ПЦР) с использованием праймеров, синтезированных фирмой «Синтол» (Москва, Россия) [12][13].
Статистический анализ результатов проводился с помощью пакета программ Microsoft Excel 2007.
Результаты исследования
Установлено, что из секрета предстательной железы 51 ± 7,62% мужчин с ХБП были выделены энтерококки, среди всех выделенных микроорганизмов, штаммы E. faecalis изолировали в 18,0 ± 8,1% случаев. При этом в монокультуре они обнаруживались в 72,7 ± 7,8% случаев, в ассоциациях с коагулазоотрицательными стафилококками (Staphylococcus epidermidis, S. haemolyticus) – в 27,3 ± 7,8% случаев. Обсемененность секрета простаты энтерококками составляла в среднем 3×10³ КОЕ/мл.
У выделенных штаммов E. faecalis определен комплекс биологических свойств (вирулентные и персистентные характеристики) (рис. 1). Показано наличие у штаммов E. faecalis ГА у 68,1 ± 12,3% штаммов со средним значением 8,6 ± 0,8%; адгезивной способностью характеризовалось 59,1 ± 13,6% культур энтерококков со средним показателем 36,9 ± 1,3%.
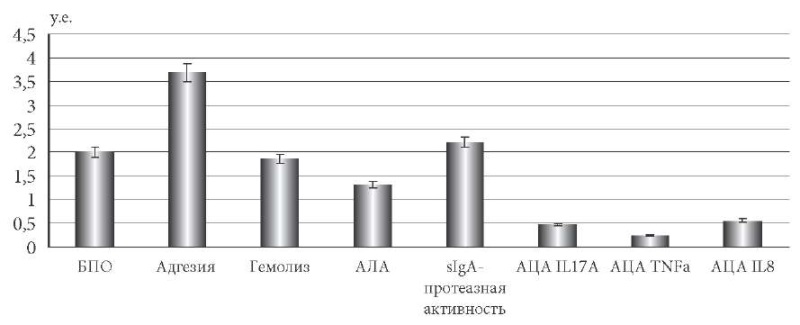
Рис. 1. Экспрессия факторов патогенности клинических штаммов E. faecalis.
Примечание: для составления биопрофиля выраженность
факторов патогенности приводили к условным единицам (у. е.):
за одну у. е. принимали 1 мкг/мл·ОП АЛА; 1 у. е. БПО;
за 10 у. е. – 100% инактивации sIgA, ИЛ-17А, ИЛ-8, TNF-α,
гемолитическая и адгезивная активность.
Установлено, что АЛА и БПО обладали все штаммы, при этом коэффициент БПО был равен 2,0 ± 0,1 у. е., а уровень АЛА составил 1,32 ± 0,04 мкг/мл*ОП. Анализ частоты встречаемости sIgA-протеазной активности у изученных штаммов энтерококков показал наличие данного признака у всех культур со средним значением 22,1 ± 0,4%.
Проявление АЦА у энтерококков различалось в зависимости от вида цитокинов. Так, IL17A инактивировало 31,8 ± 17,6% штаммов, IL8 – 68,2 ± 12,0% культур, а TNF-α – все изоляты энтерококков, с уровнем выраженности признака 4,7 ± 0,1; 5,6 ± 0,2; 2,5 ± 0,3 пг/мл соответственно.
Установлено, что все штаммы E. faecalis имели в составе генома какие-то гены вирулентности, в том числе в различных комбинациях (рис. 2). Гены протеолитических ферментов gelE и sprE были выявлены у 63,6 ± 10,3 и 54,5 ± 10,6% штаммов соответственно. Гены, ответственные за продукцию цитолизинов cylLl и cylM, зарегистрированы у 54,5 ± 10,6% культур, cylА, cylB и cylLs – у 45,5 ± 10,6% штаммов. Ген esp содержали 45,5 ± 10,6% изолятов, а ген asa – 81,8 ± 8,2% клинических штаммов. Детерминанты, кодирующие синтез энтероцинов и ответственные за продукцию гиалуронидазы, у изученных штаммов E. faecalis не были выявлены.
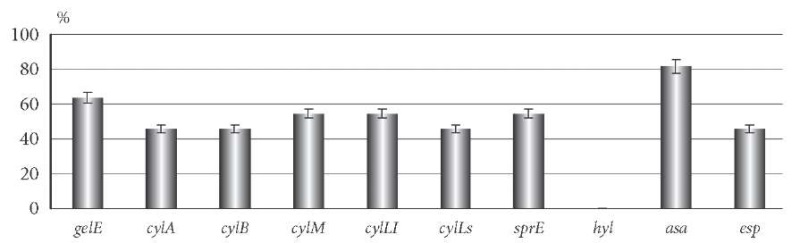
Рис. 2. Частота выявления генетических детерминант
факторов патогенности у клинических штаммов E. faecalis.
У 9,1 ± 6,1% штаммов энтерококков изолированно встречался один ген gelE, у остальных урогенитальных изолятов E. faecalis зафиксировано наличие сочетаний генов: два гена (gelE и sprE) присутствовало у 9,1 ± 6,1% культур, три гена (gelE, sprE и asa) обнаружено у 45,5 ± 10,6% изолятов, а комбинация из 7 генов (полный комплекс генов сyl-оперона) определилась у 36,6 ± 10,3% изолятов.
Все культуры E. faecalis были резистентны к амикацину, в 90,1 ± 6,4% случаев – к канамицину, в 63,3 ± 10,3% – к неомицину, к гентамицину и тетрациклину – в 36,4 ± 10,3%, к ванкомицину – в 72,7 ± 9,5% (рис. 3).
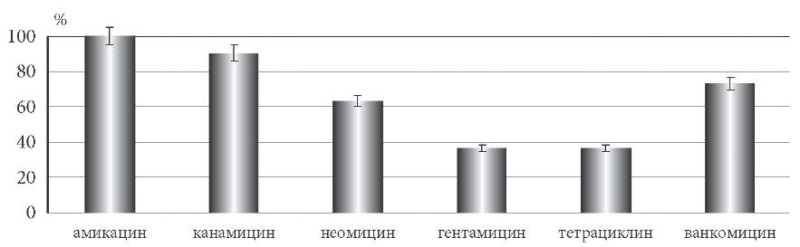
Рис. 3. Распространенность антибиотикорезистентности
среди клинических штаммов E. faecalis на фенотипическом уровне.
У выделенных изолятов E. faecalis была изучена распространенность детерминант резистентности к указанным антибиотикам (рис. 4). Определено наличие гена aac(6')-Ie-aph(2»)-Ia у 18,2 ± 8,2% культур, а гена aph(3')-IIIa – в геноме всех клинических изолятов, тогда как ген ant(4')-Ia с аналогичной функцией не был обнаружен ни у одного из штаммов.
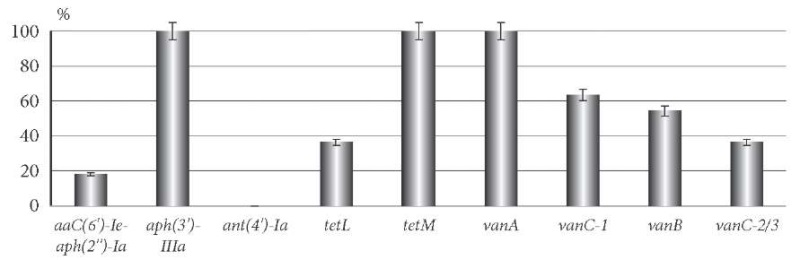
Рис. 4. Частота выявления генетических детерминант антибиотикорезистентности
у клинических штаммов E. faecalis.
Ген tetM (резистентность к тетрациклину и миноциклину) выявлялся у всех штаммов E. faecalis, а ген tetL – только у 36,4 ± 10,3% культур.
Анализ наличия генов резистентности к гликопептидам выявил, что все культуры обладали геном vanA; в 54,5 ± 10,6% случаев содержали ген vanB, а гены vanC-1 и vanC-2/3 определялись у 63,6 ± 10,3 и 36,4 ± 10,3% клинических изолятов E. faecalis соответственно.
Обсуждение полученных данных
Факторы вирулентности и персистенции бактерий участвуют в инициации воспалительного процесса в инфицированных биотопах макроорганизма, способствуют увеличению продолжительности инфекционно-воспалительных заболеваний и их хронизации [14][15]. Обнаруженная у всех изученных клинических изолятов фекального энтерококка способность к инактивации лизоцима макроорганизма и биопленкообразованию определяется как патогенетически значимый фактор развития ХБП. Не исключено, что этому способствует наличие у урогенитальных штаммов энтерококков способности инактивировать TNF-α, который усиливает воспалительный процесс и способствует санации тканей от патогенов. Мы также обнаружили способность энтерококков ингибировать sIgA, играющий важную роль в иммунной защите слизистых оболочек от бактериальной агрессии.
Анализ генотипов E. faecalis показал наличие у них генов gelE, sprE, esp, asa, комплекса генов cyl-оперона. Ранее показано, что подобные генетические детерминанты обнаруживаются преимущественно у клинических изолятов E. faecalis, тогда как у энтерококков – представителей нормальной микробиоты – указанные гены выявляются крайне редко [13].
Анализируя результаты антибиотикограмм изученных урогенитальных штаммов E. faecalis и данные о присутствии у них генов, кодирующих устойчивость к антибиотикам, не удалось обнаружить «оптимального» антибактериального препарата, который бы обладал высокой активностью в отношении энтерококков как потенциальных возбудителей ХБП. Можно полагать, что множественная лекарственная устойчивость энтерококков связана с неоднократно проводимыми курсами антибактериальной терапии больных с ХБП. Изученные нами изоляты энтерококков в 72,7 ± 9,5% случаев проявляли фенотипическую устойчивость к ванкомицину и часто имели в своем геноме те или иные комбинации двух и более детерминант резистентности к гликопептидам (vanA, vanB, vanC-1 и vanC-2/3).
Полученные данные указывают на необходимость проведения локального (внутрибольничного) мониторинга динамики распространения и циркуляции антибиотикорезистентных штаммов E. faecalis. Таким образом, возникает целесообразность перехода от эмпирического к персонифицированному выбору препаратов для антибактериальной терапии пациентов с ХБП.
Заключение
Урогенитальные изоляты E. faecalis имеют генетические детерминанты, кодирующие факторы вирулентности и персистенции, и определяют выраженный патогенный потенциал фекальных энтерококков. Эти микроорганизмы могут не только инициировать воспалительный процесс в предстательной железе, но и способствуют хроническому течению бактериального простатита. Выраженная устойчивость бактерий ко многим широко используемым в клинической практике антимикробным препаратам делает труднодостижимым положительный клинический эффект от проводимой антибактериальной терапии пациентов с ХБП энтерококковой этиологии.
Полученные результаты о патогенных биопрофилях урогенитальных изолятов E. faecalis полезны для оптимизации диагностики и прогнозирования ХБП. Показатели устойчивости к антибактериальным препаратам (на уровне фено- и генотипа) энтерококков позволят повысить эффективность терапии пациентов с данной патологией.
Конфликт интересов: авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Источник финансирования: исследования были проведены в рамках госзадания FUUG – 2022-0007 «Исследование симбиотических систем про- и эукариот в биологии и медицине».
Участие авторов:
Концепция и дизайн исследования – КОЛ, ПОА, ПТМ, ВАГ
Сбор и обработка материала – ПОА, ПТМ, ПЛП
Статистическая обработка – ПОА, ПЛП
Написание текста – КОЛ, ПОА, ПТМ
Редактирование – КОЛ, ПОА, ПТМ, ВАГ
Список литературы
1. Ибишев Х.С., Набока Ю.Л., Ферзаули А.Х., Коган М.И., Гудима И.А., Черный А.А. Микробиологический спектр и антибиотикочувствительность уропатогенов, выделенных при хроническом бактериальном простатите. Эффективная фармакотерапия. 2012;39:28–30.
2. Коган М.И., Набока Ю.Л., Исмаилов Р.С., Белоусов И.И., Гудима И.А. Бактериальный простатит: эпидемиология и этиология. Урология. 2018;6:144–8.doi:10.18565/urology.2018.6.144-148
3. Lobel B, Rodriguez A. Chronic prostatitis: what we know, what we do not know and what we should do! World Journal Urology. 2003;21:57–63. doi: 10.1007/s00345-003-0336-1
4. Туник Т.В., Иванова Е.Н., Григорова Е.В., Воропаева Н.М., Вишневская В.А. Спектр представителей условно-патогенной микрофлоры, выделенной из секрета простаты при хроническом бактериальном простатите. Acta Biomedica scientifica. 2017;2(5):70–3.doi: 10. 12737/article_5a3a0dd8cfc440.60849200
5. Бухарин О.В., Валышев А.В., Елагина Н.Н. Фотометрическое определение антилизоцимной активности микроорганизмов. Журнал микробиологии, эпидемиологии и иммунобиологии. 1997;(4):117–20.
6. O’Toole G, Kaplan HB, Kolter R. Biofilm formation as microbial development. Annu. Rev. Microbiol. 2000;(54):49–79.
7. Гизатулина С.С., Биргер М.О., Кулинич Л.И. Способ оценки состояния микрофлоры кишечника человека по количеству адгезивно-активных колоний и типу адгезинов. Журнал микробиологии, эпидемиологии и иммунобиологии. 1991;(4):21– 3.
8. Ханина Е.А. Определение гемолитической активности микроорганизмов фотометрическим методом с использованием сапонина. Сборник материалов региональной научно-практической конференции молодых ученых и специалистов. Оренбург. 2003;174–5.
9. Бухарин О.В., Чайникова И.Н., Валышев А.В. Способ определения антииммуноглобулиновой активности микроорганизмов. Патент РФ № 2236465.
10. Бухарин О.В., Перунова Н.Б., Чайникова И.Н., Иванова Е.В., Смолягин А.И. Антицитокиновая активность микроорганизмов. Журнал микробиологии, эпидемиологии и иммунобиологии. 2011;4:56–61.
11. МУК 4.2.1890-04 Определение чувствительности микроорганизмов к антибактериальным препаратам. М.: Минздрав России, 2005;62.
12. Кочкина Е.Е., Пашкова Т.М., Сычева М.В., Карташова О.Л. Характеристика биопрофилей бактерий рода Enterococcus, выделенных от животных. Вестник Оренбургского государственного университета. 2017;9(209):70–5.
13. Сычева М.В., Карташова О.Л., Щепитова Н.Е., Сафронов А.А. Антибиотикорезистеность бактерий рода Enterococcus, выделенных из организма человека в норме и при патологии. Антибиотики и химиотерапия. 2016;61(7-8);27–32.
14. Карташова О.Л., Пашкова Т.М., Пашинина О.А., Гриценко В.А., Михайленко С.В. Биопрофили стафилококков разных видов, выделенных из секрета предстательной железы у мужчин с хроническим бактериальным простатитом. Тихоокеанский медицинский журнал. 2023;1(91):70–4. doi: 10.34215/1609-1175-2023-1-70-74
15. Кузьмин М.Д., Пашкова Т.М., Карташова О.Л., Пашинина О.А., Попова Л.П. Биологические свойства микроорганизмов, выделенных из мочи при мочекаменной болезни. Урология. 2018;4:14–8. doi: 10.18565/urology-14-18
Об авторах
О. Л. КарташоваРоссия
ОренбургОренбург
О. А. Пашинина
Россия
Пашинина Ольга Александровна – к.б.н., старший научный сотрудник лаборатории персистенции и симбиоза микроорганизмов Института клеточного и внутриклеточного симбиоза УрО РАН – структурного научного подразделения
460000, г. Оренбург, ул. Пионерская, 11
+7 (922) 543-91-41
Т. М. Пашкова
Россия
Оренбург
В. А. Гриценко
Россия
Оренбург
Л. П. Попова
Россия
Оренбург
Рецензия
Для цитирования:
Карташова О.Л., Пашинина О.А., Пашкова Т.М., Гриценко В.А., Попова Л.П. Факторы патогенности и антибиотикорезистентность штаммов Enterococcus faecalis, выделенных из секрета предстательной железы у мужчин с хроническим бактериальным простатитом. Тихоокеанский медицинский журнал. 2024;(2):60-64. https://doi.org/10.34215/1609-1175-2024-2-60-64
For citation:
Kartashova O.L., Pashinina O.A., Pashkova T.M., Gritsenko V.A., Popova L.P. Pathogenicity factors and antibiotic resistance strains of Enterococcus faecalis isolated from prostate secretions in males with chronic bacterial prostatitis. Pacific Medical Journal. 2024;(2):60-64. (In Russ.) https://doi.org/10.34215/1609-1175-2024-2-60-64





































